I. Vị trí và cấu hình electron nguyên tử
- Cấu hình electron của photpho: 1s22p63s23p3
- Photpho ở ô thứ 15 thuộc chu kỳ 3, nhóm VA.
- Photpho có hoá trị III hoặc V.
II. Tính chất vật lí
1. Photpho trắng
- Photpho trắng là chất rắn màu trắng trong suốt.
- Photpho trắng bốc cháy ở 40oC.
- Photpho trắng rất độc.
2. Photpho đỏ
- Photpho đỏ là chất bột màu đỏ, khó nóng chảy, khó bay hơi hơn phôt pho trắng. Photpho đỏ bốc cháy ở \[{{250}^{o}}C\].
- Photpho đỏ không độc.
.png)
III. Tính chất hoá học
Photpho có các số oxi hóa -3, 0, +3,+5 =>có cả tính khử và oxi hóa
1. Tính oxi hoá
- Tác dụng với các kim loại hoạt động tạo ra photphorua kim loại.
- Ví dụ: \[\overset{0}{\mathop{P}}\,+3Ca\xrightarrow{{{t}^{0}}}C{{a}_{3}}\overset{-3}{\mathop{{{P}_{2}}}}\,\] (canxi photphua)
2. Tính khử
Tác dụng với kim loại hoạt động như oxi, halogen, lưu huỳnh,… và các hợp chất có tính oxi hóa.
Cháy trong oxi
- Dư oxi:
\[4P+5{{O}_{2}}\xrightarrow{{{t}^{0}}}2{{P}_{2}}{{O}_{5}}\] (điphotpho pentaoxit)
- Thiếu oxi:
\[4P+3{{O}_{2}}\xrightarrow{{{t}^{0}}}2{{P}_{2}}{{O}_{3}}\] (điphotpho trioxit)
Tác dụng với clo
- Thiếu clo: \[2P+3C{{l}_{2}}\xrightarrow{{{t}^{0}}}2PC{{l}_{3}}\] (photpho triclorua)
- Dư clo: \[2P+5C{{l}_{2}}\xrightarrow{{{t}^{0}}}2PC{{l}_{5}}\] (photpho pentaclorua)
IV. Ứng dụng
- Photpho được sử dụng làm diêm, phân lân, thuốc bào vệ thực vật.
- Dùng trong quân sự.
V. Trạng thái tự nhiên
Photpho tồn tại ở dạng hợp chất chủ yếu là photphorit và apatit.
VI. Sản xuất
\[C{{a}_{3}}{{\left( P{{O}_{4}} \right)}_{2}}+3Si{{O}_{2}}+5C\xrightarrow{{{1200}^{0}}C}3CaSi{{O}_{3}}+5CO+2P\]
BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Bài 1( Trang 49 – SGk)
Nêu những điểm khác nhau về tính chất vật lí giữa P trắng và P đỏ. Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại ?
Bài giải
- Những điểm khác nhau về tính chất vật lí:
.png)
- Sự chuyển đổi giữa P trắng và P đỏ:
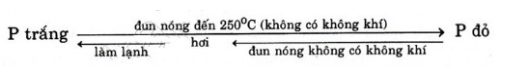
Bài 2 (Trang 49 – SGk)
Lập phương trình hóa học của các phản ứng sau đây và cho biết trong các phản ứng này, P có tính khử hay tính oxi hóa:
P + O2 → P2O5
P + Cl2 → PCl3
P + S → P2S3
P + S → P2S5
P + Mg → Mg3P2
P + KClO3 → P2O5 + KCl
Bài giải
4P + 5O2 → 2P2O5
2P + 3Cl2 → 3PCl3
2P + 3S → P2S3
2P + 5S → P2S5
2P + 3Mg → Mg3P2
6P + 5KClO3 →3 P2O5 +5 KCl
(5): p thể hiện tính oxi hóa
(1) (2) (3) (4) (6): p thể hiện tính khử 3.
Bài 3 (Trang 49 – SGK)
Thí nghiệm ở hình 2.13 chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hóa học của phản ứng xảy ra.
.png)
Bài giải
P đỏ được đặt trên thanh sắt gần ngọn lửa hơn P trắng (to cao hơn). Hiện tượng: P trắng bốc cháy còn P đỏ thì không. Chứng tỏ P trắng dễ phản ứng với oxi hơn P đỏ rất nhiều. Thực tế P trắng có thể bị oxi hoá trong không khí ở nhiệt độ thường (hiện tượng phát quang hoá học), còn P đỏ thì bốc cháy khi đun nóng ở nhiệt độ 250oC.
4P +5O2 → 2P2O5
Bài 4 (Trang 50 – SGk)
Nêu những ứng dụng của photpho. Những ứng dụng đó xuất phát từ tính chất gì của photpho ?
Bài giải:
- Ứng dụng:
+ P đỏ được dùng trong sản xuất diêm.
+ Điều chế axit photphoric, thuốc trừ sâu chứa photpho…
+ Dùng trong quân sự: sản xuất bom, đạn cháy, đạn khói…
+ Photpo còn là một nguyên tố rất cần cho con người nhất là trí thông minh, sáng tạo, phát triển xương. Cần cho cây nhất là cấy ăn quả.
- Những ứng dụng đó xuất phát từ tính khử và tính oxi hoá của photpho.
Bài 5 (Trang 50 – SGK)
Đốt cháy hoàn toàn 6,2 g photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng dung dịch NaOH đã dùng.
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng.
Bài giải:
a. Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b. np = 6,2/31 = 0,2(mol) ⇒ nP2O5 = 1/2. nP = 1/2. 0,2 = 0,1 mol
Theo pt: nNaOH = 4. nP2O5 = 4. 0,1 = 0,4 mol
Khối lượng NaOH = 0,4. 40 = 16 g
Khối lượng dung dịch NaOH = (16.100)/32 = 50,0 g
c. Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2
C% dd Na2HPO4 = … x 100% = 44,2 %







