AXIT PHOTPHORIC
I.Cấu tạo phân tử và tính chất vật lí
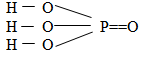
- Trong hợp chất H3PO4, Photpho có số oxi hóa cao nhất là +5
- Acid photphoric là tinh thể trong suốt, nóng chảy ở 42,5oC.
- Rất háo nước và tan vô hạn trong nước.
II.Tính chất hóa học
1.Acid Photphoric là acid 3 nấc, có độ mạnh trung bình.
Nó có tất cả những tính chất chung của acid.
- Nấc 1: \[{{H}_{3}}P{{O}_{4}}\rightleftarrows {{H}^{+}}+{{H}_{3}}P{{O}_{4}}^{-}\]
- Nấc 2: \[{{H}_{3}}P{{O}_{4}}^{-}\rightleftarrows {{H}^{+}}+HPO_{4}^{2-}\]
- Nấc 3: \[HPO_{4}^{2-}\rightleftarrows {{H}^{+}}+PO_{4}^{3-}\]
Trong dung dịch , H3PO4 có các ion:
- H2PO4- : dihidrophotphat
- HPO42- : hidrophotphat
- PO43- : photphat và ion H+
2.Tác dụng với dung dịch kiềm
Tùy theo lượng chất tác dụng mà acid photphoric tạo ra muối acid, muối trung hòa hoặc hỗn hợp mưới đó. Ví dụ:
H3PO4 + NaOH → Na H2PO4 + H2O
H3PO4 + NaOH → Na2 HPO4 + 2H2O
H3PO4 + NaOH → Na 3PO4 + 3H2O
3.Acid photphoric không có tính oxi hóa.
III.Điều chế
1.Trong phòng thí nghiệm
P + HNO3 đặc \[\xrightarrow{{{t}^{0}}}\]H3PO4 + 5NO2 + H2O
2.Trong công nghiệp
- Đi từ quặng photphorit hoặc apatit.
Ca3(PO4)2 + 3H2SO4 đặc →(to) 2 H3PO4 + 3CaSO4↓
- Đi từ photpho: có độ tinh khiết và nồng độ cao hơn.
P + 5O2 →(to) 2P2O5
P2O5 + 3 H2O → 2 H3PO4
IV.Ứng dụng
Điều chế muối photphat, sản xuất phân lân, thuốc trừ sâu, dược phẩm.
MUỐI PHOTPHAT
Các loại muối photphat
Muối photphat trung hòa: Na3PO4, (NH4)3PO4, Ca3(PO4)2 ,...
Muối acid:
- Muối hidrophotphat: Na2HPO4, CaHPO4, (NH4)2HPO4,…
- Muối dihidrophotphat: NaH2PO4, Ca(H2PO4)2, NH4H2PO4,…
I.Tính tan
- Các muối trung hòa và các muối acid của kim loại Natri, Kali nà Amoni đều tan trong nước.
- Với các kim loại khác, chỉ có muối dihidrophotphat là tan được, ngoài ra đều không tan hoặc ít tan trong nước.
II.Nhận biết ion photphat
- Dùng AgNO3 làm thuốc thử để nhận biết các muối photphat tan.
3Ag+ + PO43- → AgPO4↓ vàng
Bài 1 (Trang 53 – SGK)
Viết phương trình hóa học dạng phân tử và dạng ion rút gọn của phản ứng giữa H3PO4với lượng dư của:
a) BaO b) Ca(OH)2 c) K2CO3
Bài giải:
Các chất lấy dư nên muối tạo ra là muối trung hoà:
a. 2H3PO4 + 3BaO → Ba3(PO4)2 + 3H2O
Phương trình phân tử trùng với phương trình ion thu gọn
b. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2H3PO4 + 3Ca2+ + 6OH- → Ca3(PO4)2 + 6H2O
c. 2H3PO4 + 3K2CO3 → 2K3PO4 + 3H2O + 3CO2↑
2H3PO4 + 3CO32- → 2PO43- + 3H2O + CO2↑
Bài 2 (Trang 53 – SGK)
Nêu những điểm giống nhau và khác nhau về tính chất hóa học giữa axit nitric và axit photphoric. Dẫn ra những phản ứng hóa học để minh họa.
Bài giải:
- Những tính chất chung:
Đều có tính axit
+ Chuyển màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
+ Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Tác dụng với một số muối của axit yếu và không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
- Những tính chất khác nhau:
.png)
Bài 3 (Trang 54 – SGK)
Phương trình điện li tổng cộng của H3PO4 trong dung dịch là:
H3PO4 ⇌ 3H+ + PO43-
Khi thêm HCl vào dung dịch:
A. Cân bằng trên chuyển dịch theo chiều thuận.
B. Cân bằng trên chuyển dịch theo chiều nghịch.
C. Cân bằng trên không bị dịch chuyển.
D. Nồng độ PO43- tăng lên.
Bài giải:
Chọn B
Theo nguyên lí chuyển dich cân bằng: cân bằng chuyển dịch theo hướng làm giảm tác động vào hệ. Do đó khi thêm H+ vào dung dịch, cân bằng trên chuyển dịch theo chiều nghịch tạo thành H3PO4.
Bài 4 (Trang 54 – sGK)
Lập phương trình hóa học sau đây:
a) H3PO4 + K2HPO4 →
1 mol 1 mol
b) H3PO4 + Ca(OH)2 →
1 mol 1 mol
c) H3PO4 + Ca(OH)2 →
2 mol 1 mol
d) H3PO4 + Ca(OH)2 →
2 mol 3 mol
Bài giải:
a. H3PO4 + K2HPO4 → 2KH2PO4
1 mol 1mol
b. H3PO4 + Ca(OH)2 → CaHPO4 + 2H2O
1 mol 1mol
c. 2H3PO4 + Ca(OH)2 → Ca(H2PO4)2 + 2H2O
2mol 1mol
d. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2mol 3mol
Bài 5 (Trang 54 – SGK)
Để thu được muối photphat trung hòa, cần lấy bao nhiêu ml dung dich NaOH 1,00 M cho tác dụng với 50,0 ml dung dịch H3PO4 0,50 M ?
Bài giải:
Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml







