I.TÓM TẮT LÍ THUYẾT
1. NHÔM
1.1. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
- Cấu hình electron: 1s2 2s22p6 3s23p1. ⇒ Al: thuộc nhóm IIIA, chu kỳ 3.
- Nhôm dể nhường 3 e hoá trị, nên có số oxi hoá +3.
1.2. Tính chất vật lí của Nhôm
- Là kim loại nhẹ ,màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm.
- Rất dẻo, có thể dát được lá nhôm mõng 0,01 mm dùng để gói thực phẩm.
- Có cấu tạo mạng lập phương tâm diện ,có mật độ electron tự do tượng đối lớn. Do vậy nhôm có khả năng dẩn điện và nhiệt tốt.
1.3. Tính chất hóa học của Nhôm
Nhôm là kim loại có tính khử mạnh, nên nó bị oxi hoá dể dàng thành ion nhôm Al3+ . Ta có: Al → Al3+ + 3e
a. Tác dụng với Halogen
Thí nghiệm Nhôm tác dụng với khí Clo: 2Al + 3Cl2 → 2AlCl3 .
b. Tác dụng với oxi
Thí nghiệm của Nhôm và Oxi: 4Al + 3 O2 → 2Al2O3
c. Tác dụng với axit
- Thí nghiệm Nhôm tác dụng với Axit HCl: 2Al + 6 HCl → 2AlCl3 + 3 H2
- Thí nghiệm Nhôm phản ứng với axit HNO3 và H2SO4 đặc, nóng: Al + 4HNO3 loãng → Al(NO3)3 + 2H2O + NO.
- Chú ý: Nhôm bị thụ động trong HNO3 và H2SO4 đặc nguội.
d. Tác dụng với oxit kim loại
Thí nghiệm của Nhôm vào Sắt (III) oxit: 2Al + Fe2O3 \(\overset{t^{0}}{\rightarrow}\) Al2O3 + 2Fe
e. Tác dụng với nước
- Vật bằng nhôm không tác dụng với nước ở bất kỳ nhiệt độ nào vì trên bề mặt nhôm được phủ bởi một lớp Al2O3 rất bền. Nếu phá bỏ lớp bảo vệ này, thì nhôm tác dụng được với nước
- Phản ứng: 2 Al + 6 H2O → 2 Al(OH)3 + 3 H2
- Al(OH)3 là chất rắn, không tan trong nước là lớp bảo vệ không cho nhôm tiếp xúc với nước nên phản ứng nhanh chóng bị dừng lại.
f. Tác dụng với dung dịch kiềm
Al2O3 + 2 NaOH → 2NaAlO2 + H2O
2Al + 6H2O → 2Al(OH)3 + 3H2 (2)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (3)
Phản ứng (2), (3) xảy ra xen kẽ nhau mãi cho đến khi nhôm bị tan hết .
2Al + 2NaOH + 2H2O → NaAlO2 + 3 H2
1.4. Ứng dụng và trạng thái tự nhiên
a. Ứng dụng
- Dùng chế tạo máy bay, ô tô, tên lửa …
- Trang trí nội thất, xây dựng nhà cửa.
- Dẫn điện, dẩn nhiệt tốt nên dùng làm dây cáp dẩn điện.
b. Trạng thái tự nhiên
Nhôm là kim loại hoạt động mạnh nên trong tự nhiên chỉ tồn tại ở dạng hợp chất như: đất sét, mica, criolit …
1.5. Sản xuất Nhôm
a. Nguyên liệu
- Quặng boxit Al2O3 .2H2O quặng thường lẫn tạp chất là Fe2O3 và SiO2, nên ta phải làm sạch nguyên liệu
b. Nguyên tắc
- Khử ion Al3+ thành Al.
b. Phương pháp
- Vì sự khử ion Al3+ trong Al2O3 là rất khó khăn, không thể dùng các chất khử thông thường như CO, C, H2 … mà ta phải dùng phương pháp điện phân nóng chảy với xúc tác là criolit (Na3AlF6 ) nhằm giảm nhiệt độ nóng chảy của Al2O3 (2050 oC → 900oC ) để tiết kiệm năng lượng, và tạo được chất lỏng có tính dẫn điện tốt hơn.
- Quá trình điện phân:
- Cực (-) : Al3+ + 3e → Al
- Cực ( +) :Xảy ra sự oxi hoá 2O2- → O2 + 4e
2. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA NHÔM
2.1. Nhôm oxit Al2O3
a. Tính chất vật lí
- Al2O3 là chất rắn, màu trắng, không tan trong nước và không tác dụng với nước, t0nc=20500C.
b. Tính chất hóa học
- Tính bền ⇒ Al2O3 khó bị khử à Al bằng C, H2, CO.
- Tính chất lưỡng tính:
- Al2O3+6HCl → 2AlCl3 + 3 H2O
- Al2O3+2NaOH → 2NaAlO2+H2O
c. Ứng dụng
- Thường tồn tại dưới dạng ngậm nước và dạng khan:
- Dạng oxit ngậm nước là thành phần chủ yếu quặng boxit là nguyên liệu sản xuất nhôm.
- Dạng oxit khan có cấu tạo tinh thể giống đá quý: Tinh thể corindon trong suốt, không màu, rất rắn, chế tạo đá mài, giấy nhám…
- Bột nhôm oxit xúc tác cho tổng hợp hữu cơ.
2.2. Nhôm hidroxit Al(OH)3
a. Tính chất vật lí
- Là chất kết tủa keo, màu trắng
- Không tan trong nước, trong dd CO2, NH3 nhưng tan được trong môi trường H+ và OH- mạnh.
b. Tính chất hóa học
- Tính chất kém bền nhiệt: \(2Al(OH)_{3} \overset{t^{0}}{\rightarrow}Al_{2}O_{3} + 3H_{2}O\)
- Tính chất lưỡng tính:
- Al(OH)3+ 3HCl → AlCl3 + 3H2O
- Al(OH)3+NaOH → NaAlO2+ 2H2O
2.3. Nhôm Sunfat Al2(SO4)3
- Muối nhôm sunfat khan tan trong nước → tỏa nhiệt do bị hiđrat hóa.
- Phèn chua: K2SO4.Al2(SO4)3.24H2O hay viết gọn: KAl(SO4)2.12H2O.
- Dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong ngành dệt vải, làm trong nước…
- 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
2.4. Nhận biết ion Al3+ trong dung dịch
- Cho từ từ dd NaOH dư vào dung dịch, nếu thấy có kết tủa keo xuất hiện rồi tan trong dd NaOH thì chứng tỏ có ion Al3+:
- Al3+ + 3OH- → Al(OH)3
- Al(OH)3+OH-dư → AlO2- + 2H2O
II.GIẢI BÀI TẬP SÁCH GIÁO KHOA
Câu 1. (Trang 128 SGK )
Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển đổi sau:
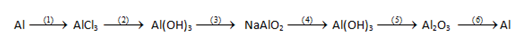
Bài làm:
Al + 6HCl → AlCl3 + 3H2
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2NaAlO2 + CO2 + 3H2O → 2Al(OH)3 + Na2CO3
Al(OH)3 →(to) Al2O3 + H2O
2Al2O3 →(đk: to, criolit) 4Al + 3O2
Câu 2. (Trang 128 SGK )
Có 2 lọ không ghi nhãn đựng dung dịch AlCl3 và dung dịch NaOH. Không dùng thêm chất nào khác, làm thế nào để nhận biết mỗi chất?
Bài làm:
Lấy ở mỗi lọ một ít làm mẫu thử cho vào 2 uống nghiệm rồi đánh số.
- Lấy dung dịch ở ông thứ nhất nhỏ dần dần vào ống thứ hai nếu sau một lát thấy có kết tủa, kết tủa tăng dần thì ống thứ nhất đựng dung dịch AlCl3 còn ống thứ hai đựng dung dịch NaOH.
- Ngược lại, nếu thấy mới đầu kết tủa, sau đó kết tủa tan dần thì ống nghiệm thứ nhất đựng dung dịch NaOH, ống nghiệm thứ hai đựng dung dịch AlCl3.
Câu 3. (Trang 128 SGK )
Phát biểu nào sau đây là đúng?
A. Nhôm là 1 kim loại lưỡng tính.
B. Al(OH)3 là một bazơ lưỡng tính.
C. Al2O3 là một oxit trung tính.
D. Al(OH)3 là một hiđroxit lưỡng tính.
Bài làm:
Đáp án D
A. Sai, Nhôm là 1 kim loại lưỡng tính.
B. Sai, Al(OH)3 là một bazơ lưỡng tính.
C. Sai, Al2O3 là một oxit trung tính.
D. Đúng, Al(OH)3 là một hiđroxit lưỡng tính.
Câu 4. (Trang 128 SGK )
Trong những chất sau, chất nào không có tính lưỡng tính?
A. Al(OH)3;
B. Al2O3;
C. ZnSO4;
D. NaHCO3.
Bài làm:
Đáp án C
Trong những chất trên, chất không có tính lưỡng tính là ZnSO4.
Câu 5. (Trang 128 SGK )
Cho một lượng hỗn hợp Mg – Al tác dụng với dung dịch HCl dư thu được 8,96 lít H2. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít H2. Các thể tích khí đều đo ở đktc.
Tính khối lượng của mỗi kim loại có trong lượng hỗn hợp đã dùng.
Bài làm:
Khi cho hỗn hợp Mg – Al tác dụng với NaOH chỉ có Al tác dụng:
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,2 ⟵ \[\frac{6,72}{22,4}\] = 0,3
Khi cho hỗn hợp Mg – Al tác dụng với HCl cả hai kim loại tác dụng: nH2 = \[\frac{8,96}{22,4}\] = 0,4 (mol)
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2 ↑
(mol) 0,2 → 0,3
Mg + 2HCl → MgCl2 + H2 ↑
(mol) 0,1 ⟵ 0,1
=> mMg = 21.0,1 = 2,4 (g);
mAl = 27.0,2 = 5,4 (g).
Câu 6. (Trang 129 SGK )
Cho 100 ml dung dịch AlCl3 1M tác dụng với 200 ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55 gam. Tính nồng độ mol của dung dịch NaOH ban đầu.
Bài làm:
Ta có nAlCl3 = 0,1.1 = 0,1 (mol); nAl2O3 = \[\frac{2,55}{102}\] = 0,025 (mol)
Khi cho dung dịch AlCl3 tác dụng với dung dịch NaOH. Các phản ứng có thể xảy ra:
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl (1)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (2)
TH1: NaOH thiếu => chỉ xảy ra phản ứng (1)
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl
2Al(OH)3 →(to) Al2O3 + 3H2O
0,05 0,025
=>CM (NaOH) = \[\frac{0,15}{0,2}\] = 0,75 (M).
TH2: NaOH dư một phần, xảy ra cả hai phản ứng (1) và (2)
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl
0,1 0,3 0,1
Al(OH)3 + NaOH → NaAlO2 + 2H2O
0,05 0,05
2Al(OH)3 →(to) Al2O3 + 3H2O
0,05 0,025
=> nNaOH = 0,3 + 0,05 = 0,35 (mol); CM (NaOH) = \[\frac{0,35}{0,2}\] = 1,75 (M).
Câu 7. (Trang 129 SGK )
Có 4 mẫu kim loại là Na, Al, Ca, Fe. Chỉ dùng nước làm thuốc thử thì số kim loại có thể phân biệt được tối đa là bao nhiêu?
A. 1.
B. 2.
C. 3.
D. 4.
Bài làm:
Đáp án D.
Cho từng mẫu kim loại tác dụng với nước
- Mẫu kim loại nào phản ứng mạnh, giải phóng chất khí, dung dịch thu được trong suốt là Na.
- Mẫu kim loại phản ứng mạnh, giải phóng chất khí, dung dịch thu được vẩn đục là Ca vì tạo ra Ca(OH)2 ít tan.
Lấy dung dịch dung dịch NaOH vừa thu được cho tác dụng với 2 kim loại còn lại.
- Kim loại nào tan được và giải phóng ra khí là Al, kim loại không phản ứng là Fe.
Câu 8. (Trang 129 GK)
Điện phân Al2O3 nóng chảy với dòng điện cường độ 9,65 A trong khoảng thời gian 3000 giây, thu được 2,16 gam Al. Hiệu suất của quá trình điện phân là.
A. 60%.
B. 70%.
C. 80%.
D. 90%.
Bài làm:
Đáp án C
Theo đinh luật Faraday khối lượng nhôm thu được là :
mAl = \[\frac{Alt}{96500.n}=\frac{27.9,65.3000}{96500.3}\] = 2,7(g)
Vậy hiệu suất là H = \[\frac{2,16}{2,7}\]x 100% = 80%.







