CHUYÊN ĐỀ: AMINA)LÝ THUYẾT
1)Khái
niệm
-Khi thay thế
một hay nhiều nguyên tử hidro trong phân tử $N{{H}_{3}}$bằng một hay nhiều gốc
hidrocacbon ta thu được amin.
2)Phân loại
a) dựa vào cấu
tạo gốc hidrocacbon
-amin thơm :
\[C{{H}_{3}}N{{H}_{2}}\],….
-amin béo : \[{{C}_{6}}{{H}_{5}}N{{H}_{2}}\],…
-amin dị
vòng
b)
dựa vào bậc amin
‘’bậc amin’’= số nguyên tử hidro trong nhóm NH3 bị thay thế bằng gốc HĐC

3)
Danh pháp
a) tên thay
thế = tên HĐC tương ứng trong mạch chính+ số chỉ vị trí của NH2+ amin
b) tên gốc
chức= tên các gốc H-C + amin
4) Tính chất vật lý
-amin tan tốt
trong nước (lien kết H với nước)
-amin có nhiệt
độ sôi cao (lien kết H liên phân tử)
*chú ý :
+anilin (\[{{C}_{6}}{{H}_{5}}N{{H}_{2}}\]) là chất Lỏng, ít tan trong nước, tan
nhiều trong dung môi hữu cơ như benzene, ancol..
+ anilin rất độc, trong không khí
dễ bị oxi hóa và chuyển sang màu nâu đen.
5)
Đồng đẳng- đồng phân
-Tổng quát : với một hợp chất hữu có chứa 1 N luôn có công thức tổng
quát là \[{{C}_{x}}{{H}_{y}}{{O}_{z}}N\](1)
K=\[\frac{2x+3-y}{2}\] nên y= 2x+3-2k
Từ(1)
ta suy ra được công thức tổng quát \[{{C}_{n}}{{H}_{2n+3-2k}}{{O}_{z}}N\]
\[{{C}_{n}}{{H}_{2n+3-2k}}{{O}_{z}}N\]+
\[{{O}_{2}}\]-------> n\[C{{O}_{2}}\]+ (n+1,5-k) \[{{H}_{2}}\] +0,5N2
+) k=0
amin no, đơn chức, mạch hở \[{{C}_{n}}{{H}_{2n+3}}N\]
+K=1 amin đơn chức, mạch hở 1 nối đôi
C=C (\[{{C}_{n}}{{H}_{2n+1}}N\])
-Số đồng phân của amin no, đơn chức: \[{{2}^{n-1}}\]
( n là số nguyên tử C)
- Bậc của amin được tính bằng bậc của
nguyên tố N ( Tính nhanh= 3-số nguyên tử H trên N)
6)Tính
chất hóa học
a) Do nguyên tử N trong nhóm chức amin
còn đôi e chưa liên kết nên có khả năng nhận proton (h+) bằng cách tạo liên kết
cho- nhận=> amin có tính bazo
- Tương tự
như NH3 các amin đều có tính bazơ, tan trong nước làm xanh quỳ tím
- Tính
bazơ của amin càng mạnh khi có nhóm ankyl (\[C{{H}_{3}}\];-\[{{C}_{2}}{{H}_{5}}\];-\[{{C}_{3}}{{H}_{7}}\]) nhóm đẩy điện tử. Nhóm ankyl có ảnh hưởng làm tăng mật
độ electron của nguyên tử nitơ do đó làm tăng lực bazơ.
- Tính
bazơ của amin càng yếu khi có nhóm hút electron (như \[C{}_{6}{{H}_{5}}\] -, CH2 = CH-,...) nhóm
này làm giảm mật độ electron của nguyên tử nitơ nên giảm lực bazơ.
-Anilin và các amin thơm (\[{{C}_{6}}{{H}_{5}}NHC{{H}_{3}}\]: amin thơm bậc II, (\[{{(C{{H}_{3}})}_{2}}N-{{C}_{6}}{{H}_{5}}\],- amin thơm bậc III) rất ít tan trong nước. Dung dịch của chúng không làm đổi màu quỳ tím và phenolphtalein.
b. Tác dụng với axit sinh ra muối amoni
\[C{{H}_{3}}N{{H}_{2(k)}}+HCl\to \left[ C{{H}_{3}}N{{H}_{3}}
\right]+Cl-\]
metylamoni clorua
\[2C{{H}_{3}}C{{H}_{2}}N{{H}_{2}}+{{H}_{2}}S{{O}_{4}}\to
{{\left( C{{H}_{3}}C{{H}_{2}}N{{H}_{3}} \right)}_{2}}S{{O}_{4}}\]
\[C{{H}_{3}}N{{H}_{2}}+HN{{O}_{3}}\to
\left( C{{H}_{3}}N{{H}_{3}}N{{O}_{3}} \right)\]
\[{{C}_{6}}{{H}_{5}}N{{H}_{2}}+HCl\to
{{C}_{6}}{{H}_{5}}N{{H}_{3}}Cl\]
(phenylamoni clorua)
Tuy vậy,
vì amin là những bazơ yếu nên các muối này dễ dàng tác dụng với kiềm giải phóng
amin, ví dụ:
\[{{C}_{6}}{{H}_{5}}N{{H}_{3}}Cl+NaOH\to
{{C}_{6}}{{H}_{5}}N{{H}_{2}}+NACl+{{H}_{2}}O\]
c. Tác dụng
với dung dịch muối của một số kim loại tạo ra kết tủa hiđroxit tương ứng.
\[3C{{H}_{3}}N{{H}_{2}}+3{{H}_{2}}O+FeC{{l}_{3}}\to Fe{{\left( OH
\right)}_{3}}+3C{{H}_{3}}N{{H}_{3}}Cl\]
d. Phản ứng
với axit nitrơ (HNO2)
- Amin bậc
I tác dụng với HNO2 ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ
- Amin các
bậc khác nhau tác dụng với axit nitrơ theo các cách khác nhau, nhờ đó ta có thể
phân biệt được các bậc amiN
\[{{C}_{2}}{{H}_{5}}N{{H}_{2}}+HONO\to
{{C}_{2}}{{H}_{5}}OH+{{N}_{2}}+{{H}_{2}}O\]
\[{{\left( C{{H}_{3}}
\right)}_{2}}NH+HONO\to {{\left( C{{H}_{3}} \right)}_{2}}N-N=O+{{H}_{2}}O\]
(màu vàng)
*
(CH3)2N + HONO: Không tác dụng
- Amin bậc
I dãy thơm tác dụng với HNO2 (lạnh) tạo thành muối điazoni
e. Phản ứng
ankyl hoá
Cho amin bậc
I hoặc bậc II tác dụng với ankyl halogenua, nguyên tử H của nhóm amin có thể bị
thay thế bởi gốc ankyl.
ví dụ:
\[{{C}_{2}}{{H}_{5}}N{{H}_{2}}+C{{H}_{3}}I\to
{{C}_{2}}{{H}_{5}}NHC{{H}_{3}}+HI\]
f. Phản ứng
thế ở nhân thơm của anilin
- Các nhóm
NH2, NHCH3... là những nhóm hoạt hóa nhân thơm và định hướng các phản ứng thế
vào vị trí ortho và para.
- Tương tự
như phenol, anilin tác dụng với nước brom tạo thành kết tủa trắng 2, 4, 6 -
tribromanilin.
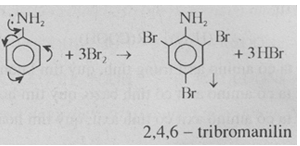
Phản ứng
này dùng để nhận biết anilin
7. Phản ứng cháy ( xem lại phàn đồng đẳng – đồng phân
về phương trình đốt cháy tổng quát)
Ví dụ: \[C{{H}_{3}}N{{H}_{2}}+\frac{9}{4}{{O}_{2}}\to
C{{O}_{2}}+\frac{5}{2}{{H}_{2}}O+\frac{1}{2}{{N}_{2}}\]
8. Điều chế
amin
- Thế
nguyên tử H của phân tử amin
-Khử hợp
chất nitro
9. ứng dụng
-Amin có nhiều ứng dụng trong tổng hợp hữu cơ,sản phẩm dùng để tổng hợp phẩm nhuộm, dược phẩm, tơ, sợi polime….
-anilin
dung để tổng hợp + Phẩm nhuộm azo, đen anilin…
+ polime- chất dẻo
B)BÀI TẬP
Dạng 1: So sánh tính bazơ của các amin
Rthơm)3N
< (R thơm)2NH < RthơmNH2 < NH2 < Rno NH2 < ((Rno)2NH < (Rno)2N
Chú ý rằng với gốc Rno càng cồng kềnh thì ảnh
hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử
N nên (Rno)2NH < (Rno)2N sẽ không còn đúng nữa.
Ví dụ 1:
So sánh tính bazơ của các hợp chất hữu cơ sau: NH2 , CH3NH2 , \[{{C}_{2}}{{H}_{5}}N{{H}_{2}}\]C6H5NH2 , (C6H5)2NH ,
(C2H5)2NH , C6H5 CH2NH2 ?
Đáp án:
(C2H5)2NH
> C2H5NH2 > CH3NH2 > NH3 > C6H5> CH2NH2 > C6H5NH2 >
(C6H5)2NH
Ví dụ
2: Cho các chất: (1) amoniac. (2) metylamin. (3) anilin. (4) dimetylamin.
Tính bazơ
tăng dần theo thứ tự nào sau đây?
A. (1)
< (3) < (2) < (4). B. (3) <
(1) < (2) < (4).
C. (1)
< (2) < (3) < (4). D. (3) <
(1) < (4) < (2).
Đáp án:
Dựa vào
tính chất trên : anilin có vòng benzen(gốc phenyl) => Tính bazo yếu nhất
NH3 ở mức
trung gian > C6H5NH2
Amin bậc I
(CH3NH2) < Amin bậc 2 (NH3 – NH –NH3)
Dạng 2: xác định số nhóm chức
Nếu đề bài cho số mol amin và số mol axit (H+) lập tỉ số :
Số nhóm chức = $\frac{nH+}{nAMIN}$
Nếu amin
chỉ có 1N => số chức = 1
Ví dụ: Để
trung hòa 50 ml dd amin no , (trong amin có 2 nguyên tử Nito ) cần 40 ml dd HCl
0,1 M . CM của đimetyl amin đã dùng là :
A.0,08M
B.0,04M C.0,02M D.0,06M
Hướng dẫn:
Amin có 2
N => amin có số chức = 2 ADCT : namin = nHCl/2 = 0,002 mol => CM amin =
0,04 M
Dạng 3: bài tập đốt cháy
Phương
trình tổng quát:
Phương pháp giải:
n${{O}_{2}}$(phản ứng)= n$C{{O}_{2}}$+
n${{H}_{2}}O$
Đốt amin no 2 chức ta có :
n${{H}_{2}}O$-n$C{{O}_{2}}$=
2n amin= 2N2
*lưu ý: khi đốt cháy amin trong khôn khí
nN2 sau phản ứng = nN2 sinh ra từ
phản ứng đốt cháy amin + nN2 có sẵn trong không khí
Ví dụ 1: Ví dụ 1: Đốt cháy hoàn toàn
amol hh X gồm 2 amin no đơn chức liêm tiếp nhau thu được 5,6 lít CO2 (đktc) và
7,2 g H2O . Giá trị của a là?
Tìm công thức hai amin đó
A. 0,05 mol B.0,1 mol C.0,15 mol D.0,2 mol
Hướng dẫn:
AD CT :
namin = (nH2O – nCO2)/1,5
= (0,4 – 0,25)/1,5 = 0,1 mol
CT amin : n = => Amin có CT : CnH2n+1NH2
n = 2 và n = 3 :C2H5NH2 và C3H7NH2
Ví dụ 2: Đốt
cháy hoàn toàn hôn hợp gồm 2 amin no, đơn hở, đồng đẳng kế tiếp rồi dẫn toàn bộ
sản phẩm cháy vào $BA{{(OH)}_{2}}$ dư thì thấy m bình tang 4,88g nhưng m dung dịch giảm
8,91g. Số đồng phân bậc 1 của amin có khối lượng nguyên tử lớn hơn là bao
nhiêu?
A. 2 B. 3 C. 4 D. 5
Hướng dẫn giải:
-m bình tang= $mC{{O}_{2}}+m{{H}_{2}}O$
-m dd giảm= m kết tủa(BACO3)-( $mC{{O}_{2}}+m{{H}_{2}}O$)
Từ đó ta tính được m kết tủa
-nbaco3=n co2 =>>nh2o
-n hỗn hợp amin= 2/3(nh20-nco2)
-$\overline{C}$amin=$\frac{nC{{O}_{2}}}{n{{H}_{2}}O}$
=> Đồng phân có ntk lớn hơn là ${{C}_{4}}{{H}_{11}}N$
Đáp án B
Dạng
4: amin tác dụng với dung dịch muối của kim loại
Một số muối dễ tạo kết tủa hidroxit
với dd amin
Ví dụ:
AlCl3 + 3CH3NH2 + 3H2O Al(OH)3 + 3CH3NH3Cl
Lưu ý:
Tương tự như NH3 các amin cũng tạo phức chất tan với Cu(OH)2, Zn(OH)2,
AgCl…
Ví dụ:
Khi sục khí CH3NH2 tới dư vào dd CuCl2 thì ban đầu xuất hiện kết tủa
Cu(OH)2 màu xanh nhạt, sau đó kết tủa Cu(OH)2 tan trong CH3NH2 dư tạo
thành dd phức [Cu(CH3NH2)4](OH)2màu xanh thẫm.
2CH3NH2 + CuCl2 + H2O Cu(OH)2 + 2CH3NH3Cl
Cu(OH)3 + 4CH3NH2 [Cu(CH3NH2)4](OH)
PHẦN 3 : BÀI TẬP TỰ LUYỆN
CÂU 1:
Amin X đơn chức, mạch hở có nito chiếm 16,092%( về khối lượng) số đồng phân
amin bậc 2 của x là
A.7 B.6 C.4 D.5
Câu 2: Hỗn
hợp khí X gồm 2 amin no, đơn chức, mạch hở thuộc cùng dãy đồng đẳng và một
anken. Đốt cháy hoàn toàn một lượng hỗn hợp X thu được 0,55 mol CO2 ; 0,925 mol H2O và V lít N2(đktc). Gía trị của
V là?
A.4,48 B. 2,8 C. 5,6 D. 22,4
Câu 3 : hỗn
hợp X gồm \[{{C}_{2}}{{H}_{7}}N\] và 2 hidrocacbon đồng đẳng kế tiếp. Đốt cháy hoàn
toán 100ml hỗn hợp X bằng một lượng \[{{O}_{2}}\] vừa đủ thu được 550ml Y gồm
khí và hơi nước. nếu cho Y đi qua dung dich axit sunfunric đặc dư thì còn lại
250 ml khí. CTPT của 2 hidrocacbon
A \[C{{H}_{4}}\]và \[{{C}_{2}}{{H}_{6}}\] B \[{{C}_{2}}{{H}_{6}}\]
và\[{{C}_{3}}{{H}_{8}}\]
C
\[{{C}_{2}}{{H}_{4}}\]và \[{{C}_{3}}{{H}_{6}}\]
D \[{{C}_{3}}{{H}_{6}}\] và \[{{C}_{3}}{{H}_{8}}\]
Câu 4: Đốt cháy hoàn toàn các amin no
đơn chức, mạch hở thì tỉ số mol CO2 và hơi nước (T) nằm trong khoảng nào sau
đây?
A
0,5≤T<1 B
0,4≤T≤0,1 C
0,4≤T<1 D
0,5≤T≤1
Câu 5: Cho 9,85 g hỗn hợp 2 amin no đơn
chức, bậc 1 tác dụng vừa đủ với dung dịch HCl thu được 18,975 g muối. khối lượng
HCl phải dufng?
A 9,512 B 9,125 C 9,215 D 9,521
Câu 6: Cho
5,9 gam hỗn hợp X gồm 3 amin: propylamin, etyletylamin, trimetylamin X tác dụng
vừa đủ với V ml dung dịch HCl 1M. Giá trị của V là
A. 100 ml B. `150 ml C. 200 ml D. 120 ml
Câu 7: Cho
15 gam hỗn hợp 3 amin đơn chức, bậc một tác dụng vừa đủ với dung dịch HCl 1,2M
thì thu được 18,504 gam muối. Thể tích dung dịch HCL phải dùng là.
A. 0,8 lít B. 0,08 lít C. 0,4 lít D. 0,04 lít
Câu 8:
Trung hòa hoàn toàn 8,88 gam một amin (bậc một, mạch cacbon không phân nhánh) bằng
axit HCL, tạo ra 17,64 gam muối. Amin có công thức.
A: ${{H}_{2}}N{{(C{{H}_{2}})}_{4}}N{{H}_{2}}$ B. $C{{H}_{3}}C{{H}_{2}}C{{H}_{2}}N{{H}_{2}}$
C.
${{H}_{2}}N{{\left( C{{H}_{2}}
\right)}_{2}}N{{H}_{2}}$ D. ${{H}_{2}}N{{\left( C{{H}_{2}}
\right)}_{3}}N{{H}_{2}}$
Câu 9: Cho
0,76 gam hỗn hợp gồm amin đồng đẳng liên tiếp tác dụng vừa đủ với V ml dung dịch
HNO3 0,5M thì thu được 2,02 gam hỗn hợp muối khan. Hai amin trên là.
A. Etylamin và propulamin. B. Metylamin và
etylamin
C. Anilin và benzylamin. D> Anilin và metanmetylanilin
Câu 10:
cho 11,8 gam amin đơn chức X tác dụng vừa đủ với dung dịch HCl, sau khi phản ứng
xảy ra hoàn toàn thu được dung dịch Y. Làm bay hơi dung dịch Y được 19,1 gam muối
khan. Số công thức cấu tạo ứng với công
thức phân tử của X là.
A. 2 B. 3 C. 4 D. 5
Câu 11:
Cho0 7,08 gam amin X phản ứng hoàn toàn với axit HCl(dư), thu được 11,46 gam muối.
Số đồng phân cấu tạo thỏa mãn với công thức cấu tạo của X là
A. 4 B. 5 C. 3 D. 2
HƯỚNG DẪN
GIẢI
Bài 1: ta có %N=\[\frac{14}{X}\]= 0,16092=> X=87 là
\[{{C}_{5}}{{H}_{13}}N\]
Đồng phân bậc 2 của X là :+ \[C{{H}_{3}}NH{{C}_{4}}{{H}_{9}}\]
có 4 đồng phân
+\[{{C}_{3}}{{H}_{7}}NH{{C}_{2}}{{H}_{5}}\] có 2 đồng phân=> đáp án B
Bài 2:
số nN2 =\[\frac{{{n}_{{{h}_{2}}o}}-{{n}_{c{{o}_{2}}}}}{2x1,5}\]=0,125=>V=2,8(l)
Bài 3:
Ta có Vx=100(l)
V\[{{H}_{2}}O\]=550-250=300(L)------> \[\overline{H}\]=6
Ta lại có =>
Đáp án B
Bài 4: đáp án C
Bài 5:
\[RN{{H}_{2}}+HCl\to RN{{H}_{3}}Cl\]
áp dụng định luật bảo toàn m \[{{m}_{HCl}}={{m}_{muoi}}-{{m}_{a\min }}\]
đáp án B
bài 6:
ctpt của amin X là \[{{C}_{3}}{{H}_{9}}N\] phản ứng với HCl theo tỷ lệ mol 1:1
ð
nhcl= naming=0,1 mol
ð
Vhcl=o,1/1=0,1
ð
Đáp án A
Bài 7:
Tương tự
bài 5
Đáp án B
Bài 8: Gọi
amin có công thức \[R{{\left(
N{{H}_{2}} \right)}_{n}}\]
\[R{{\left(
N{{H}_{2}} \right)}_{n}}\] +HCl----->\[R{{\left(
N{{H}_{3}}Cl \right)}_{n}}\]
Áp dụng định luật bảo toàn khối lượng
Ta có nHCl= 0,24 mol
-với n=1 ta có Mamin=\[\frac{8,88}{0,24}=37\]=>
loại
-với n=2 ta có Mamin=\[\frac{8,88}{0,12}\]=74=>
thỏa mãn
Vậy đáp án D
Bài 9:
Ta có
phương trình phản ứng
\[RN{{H}_{2}}+HN{{O}_{3}}\to
RN{{H}_{3}}N{{O}_{3}}\]
Áp dụng định luật bảo toàn m
Ta có \[mHN{{O}_{3}}\]=1,26 gam=>
n=0,02(mol)
\[\overline{{{M}_{a\min }}}\]=\[\frac{0,76}{0,02}\]=38
-----> Đáp án đúng là B
Bài 10:
Áp dụng định
luạt bảo toàn m
Ta có
nHCl= nx=\[\frac{19,1-11,8}{36,5}\]=0,2--->Mx=59
Tất cả có 4 đồng phân=> Đáp án C
Bài 11:
Tương tự
như bài 10
Ta tính được
Mx=59
Lưu ý: đồng
phân cấu tạo không tính đồng phân hình học
Vậy đáp án
A
Phần c: Bài tập tự rèn luyện
Bài 1
:trung hòa 11,8g một amin đơn chức cần dung 200ml dung dịch HCl 1M. công thức
phân tử của X là
A .\[{{C}_{2}}{{H}_{5}}N\] B. \[C{{H}_{5}}N\] C. \[{{C}_{3}}{{H}_{9}}N\] D. \[{{C}_{3}}{{H}_{7}}N\]
Bài 2: để trung hòa 20 gam dung dịch của
một amin đơn chức X có nồng độ 22,5% cần dung 100ml dung dịch HCl 1M. Công thức
phân tử của X là
A
\[{{C}_{2}}{{H}_{7}}N\] B \[C{{H}_{5}}N\] C \[{{C}_{3}}{{H}_{5}}N\] D \[{{C}_{3}}{{H}_{7}}N\]
Bài 3 cho 10 gam amin đơn chức X phản ứng
hoàn toàn với HCl dư thu được 15 gam muối. Số đồng phân cấu tạo của X.
A 4 B 8 C 7 D 5
Bài 4 : cho m gam anilin tác dụng hết với
dung dịch brom thu được 9,9 gam kết tủa. Gía trị m đã dung là
A
0,93 gam B
2,19gam C 1,86 gam D 3,72 gam
Bài 5 : Đốt cháy hoàn toàn 5,6 gam một
amin X đơn chức trong lượng không khí vừa đủ . Dẫn sản phẩm khí qua bình đựng
nước vôi trong dư thu được 24 gam kết tủa và có 41,664(đktc) một chất khí duy
nhất thoát ra. X tác dụng với HNO2 tạo khí N2 . X là
A . đimetylamin B
. metylamin C
.anilin D etylamin
Bài 6: đốt cháy hoàn toàn một amin no
đơn chức, mạch hở bậc một X bằng một lượng oxi vừa đủ. Sau phản ứng thu được hỗn
hợp Y gồm khí và hơi, trong đó
A 3,99 gam
B 2,895 gam C 3,26 gam D 5,085 gam
Bài 7: X và Y là 2 amin đơn chức, mạch hở có phần tram khối
lượng nito lần lượt là 31,11% và 23,73%. Cho m gam hỗn hợp gồm X và Y có tỷ lệ
số mol \[{{n}_{X}}:{{n}_{Y}}=1:3\] tác dụng với dung dịch HCl vừa đủ thu được
dung dịch chứa 44,16 gam muối. m có giá trị là
A 22,2 gam B 22,14 gam C 33,3 gam D 26,64 gam
Bài 8: Cho 1,52 gam hỗn hợp hai amin no đơn chức X và Y( được trộn với số mol bằng nhau) tác dụng
vừa đủ với 200 ml dung dịch HCl, thu được 2,89 gam muối.Kết luận nào sau đây
không chính xác
A Tên gọi hai amin là
metyl amin và etyl amin
B Nồng độ dung dịch HCl bằng 0,2 (M)
C Số mol mỗi chất là
0,02 mol
D công thức của amin
là \[C{{H}_{5}}N\] và \[{{C}_{2}}{{H}_{7}}N\]
Bài 9: Cho 20 gam hỗn hợp gồm 3 amin đơn chức , đồng đẳng kế
tiếp nhau tác dụng vừa đủ với dung dịch HCl 1M, rồi cô cạn dung dịch thì thu được
31,68 gam hỗn hợp muối. Thể tích dung dịch HCl đã dung là bao nhiêu?
A 100ml B 50ml C 200ml D 320ml
Bài 10: Hỗn hợp X gồm hai muối \[AlC{{l}_{3}}\] và \[CuC{{l}_{2}}\].
Hòa tan dung dịch X vào nước thu được 200 ml dung dịch A.Sục khí metyl amin tới
dư vào dung dịch A thu được 11,7g kết tủa. Mặt khác cho tư từ dung dịch NAOH tới
dư vào dung dịch A thu được 9,8 gam kết tủa. Nồng độ mol/l của \[AlC{{l}_{3}}\]
và \[CuC{{l}_{2}}\] lần lượt là
A . 0,1M; 0,75M
B . 0,5M; 0,75M C
.0,75M; 0,5M D .0,75M;0,1M







