Lý thuyết về cacbon và hợp chất
\[I\]) Cacbon
1) Tính
chất vật lý
-C có nhiều dạng thù hình: kim cương, than chì, và
cacbon vô định hình, fuleren
+ Kim cương là chất tinh thẻ trong suốt, không màu,
không dẫn điện,dẫn nhiệt kém. Kim cương có cấu trúc tinh thể nguyên tử và cứng
nhất trong tất cả các chất.
+ Than chì là tinh thể màu xám đen, có ánh kim, dẫn điện tốt nhưng kém hơn kim loại. Tinh thể than chì có cấu trúc lớp.
1) Tính
chất hóa học
-C có thể tồn tại ở nhiều mức oxi hóa khác nhau nhưng
thường gặp là :-4 ; 0 ; +2; +4
-C có cả tính khử và tính oxi hóa nhưng tính khử vẫn
là chủ yếu.
a. C là chất khử
-Tác dụng với các phi kim
C + O2\[\xrightarrow{{}}\]
CO2
C + CO2\[\xrightarrow{{}}\]2CO
(400\[^{o}C\])
-Tác dụng với oxit kim loại
+ C khử được
các oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C\[\xrightarrow{{{t}^{0}}}\]Cu + CO
Fe2O3 + 3C \[\xrightarrow{{{t}^{0}}}\]2Fe
+ 3CO
+ Với CaO và Al2O3
CaO + 3C \[\xrightarrow{{}}\]CaC2 + CO( trong lò điện)
2Al2O3 +9C\[\xrightarrow{{}}\]Al4C3
+ 6CO (2000\[^{O}C\])
-
Tác dụng với các
chất oxi hóa mạnh thường gặp là H2SO4 đặc; HNO3;
KNO3; KClO3; K2Cr2O7…Trong
các phản ứng này, C bị oxi hóa đến mức +4(CO2)
C + 2H2SO4\[\xrightarrow{{{t}^{o}}}\]CO2
+ 2SO2 + 2H2O
C + 4HNO3\[\xrightarrow{{{t}^{o}}}\]CO2
+ 4NO2 + 2H2O
C + 4KNO3\[\xrightarrow{{{t}^{o}}}\]2K2O
+ CO2 + 4NO2
-
Khi nhiệt độ cao,
C tác dụng với hơi nước:
C + H2O\[\xrightarrow{{{1000}^{o}}C}\]CO
+ H2O
C + 2H2O\[\xrightarrow{{}}\]CO2
+ 2H2
b. C là chất oxi hóa:
- Tác dụng với H2
C + 2H2\[\xrightarrow{\,{{500}^{0}}C,Ni}\]CH4
-Tác dụng với kim loại=> muối cacbua
4Al + 3C\[\xrightarrow{\,{{t}^{0}}}\]Al4C3
3. ứng
dụng:
- Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài.
- Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.
- Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.
- Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp phụ.
- Than muội được dùng làm chất
độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày.
4.
Trạng thái tự nhiên
- Kim cương và than chì là cacbon ở dạng tự do gần như
tinh khiết.
- Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3). Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon. Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon.
\[II\]) Cacbon monoxit ( CO)
1-Cấu tạo phân tử và tính chất vật lý:
- Cấu
tạo của CO là C≡O (trong đó có 1 liên kết thuộc kiểu cho - nhận).
- CO là chất
khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt.
- CO là khí
độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho
hemoglobin mất tác dụng vận chuyển khí O2.
2.Tính chất hóa học:
- Phân tử CO
có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều
kiện nhiệt độ cao.
- CO là oxit
trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và
dung dịch axit ở nhiệt độ thường.
- CO là chất khử mạnh.
+ Tác dụng với các phi kim
2CO + O2\[\xrightarrow{\,{{700}^{0}}C}\]2CO2
CO + Cl2\[\xrightarrow{{}}\]COCl2
(photgen)
+ CO khử oxit của các kim loại đứng sau Al
trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
3CO + Fe2O3\[\xrightarrow{{}}\]3CO2
+ 2Fe
CO + CuO\[\xrightarrow{{}}\]CO2
+ Cu
3. Điều chế

4,Nhận biết
5CO + I2O5
→ 5CO2 + I2
\[III\]) Cacbon đioxit-CO2
1.Trạng thái tự nhiên
- Cấu tạo của
CO2 là O=C=O.
- Là khí không màu, vị hơi chua. Tan ít trong nước. CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
2 Tính chất hóa học
a.
CO2 là oxit axit
-CO2 tan trong nước tạo thành axit cacbonic (là một
điaxit rất yếu)
CO2
+ H2O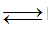 H2CO3
H2CO3
-CO2 tác dụng với oxit bazo tạo thành muối
CO2
+ CaO\[\xrightarrow{{{t}^{o}}}\]CaCO3
-CO2 tác dụng với dung dịch bazo tạo thành muối (
+ nước)
NaOH + CO2\[\xrightarrow{{}}\]NaHCO3
NaOH +
CO2\[\xrightarrow{{}}\]Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
b.CO2 bền, ở nhiệt độ cao bị nhiệt phân một
phần và tác dụng được với các chất khử mạnh.
2CO2 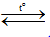 2CO
+ O2
2CO
+ O2
CO2 + 2Mg\[\xrightarrow{{}}\]2MgO
+ C
CO2 + C\[\xrightarrow{{}}\]2CO
C. CO2 còn dung để sản xuất ure
CO2 + 2NH3\[\xrightarrow{{}}\]NH4O-CO-NH2(
amoni cacbamat)
NH4O-CO-NH2\[\xrightarrow{{{180}^{o}}C,200at}\]H2O + (NH2)2CO
3.Điều chế
- Quá trình
hô hấp của người và động vật:
C6H12O6
+ 6O2 \[\xrightarrow{{}}\] 6CO2 + 6H2O
- Quá trình
lên men bia rượu:
C6H12O6
\[\xrightarrow{{}}\] 2CO2 + 2C2H5OH
- Quá trình
đốt cháy nhiên liệu:
CXHY + (x +
y/4)O2 \[\xrightarrow{{}}\]Xco2 + y/2H2O
- Trong công
nghiệp:
C + O2 \[\xrightarrow{{}}\]
CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 \[\xrightarrow{{{1000}^{o}}C}\]
CaO + CO2
- Trong
phòng thí nghiệm:
CaCO3 + 2HCl \[\xrightarrow{{}}\] CaCl2 + CO2 + H2O
4.Nhận biết
- Tạo kết tủa trắng với dung dịch nước vôi
trong dư.
CO2 + Ca(OH)2 \[\xrightarrow{{}}\]CaCO3
+ H2O
\[IV\]) Muối cacbonat
Là
muối của axit cacbonic (gồm muối CO32- và HCO3-).
1. Tính tan
Các muối cacbonat trung hoà của kim loại
kiềm (trừ Li2CO3), amoniac và các muối hidrocacbonat dễ
tan trong nước (trừ NaHCO3 ít tan). Các muối cacbonat trung hoà của
những kim loại khác không tan hoặc ít tan trong nước.
2. Tính chất hóa học
- Sự thủy
phân: Muối cacbonat của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm:
Na2CO3 \[\xrightarrow{{}}\]
2Na+ + CO32-
CO32- +
H2O ↔ HCO3- + OH-
→ trong một
số phản ứng trao đổi Na2CO3 đóng vai trò như 1 bazơ:
2AlCl3 + 3Na2CO3
+ 3H2O \[\xrightarrow{{}}\] 2Al(OH)3 + 6NaCl + 3CO2
Chú ý: Muối
(NH4)2CO3 có môi trường trung tính.
- Sự nhiệt
phân:
+ Muối cacbonat tan không bị nhiệt phân
(trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
MgCO3 \[\xrightarrow{{}}\] MgO + CO2
+ Tất cả các
muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 \[\xrightarrow{{}}\]
Na2CO3 + CO2 + H2O
Ca(HCO3)2 \[\xrightarrow{{}}\]
CaCO3 + H2O + CO2
- Tính chất
hóa học chung của muối:
+ Tác dụng với axit \[\xrightarrow{{}}\] muối mới + CO2 + H2O
NaHCO3 + HCl \[\xrightarrow{{}}\]NaCl
+ H2O + CO2
Chú ý: Nếu cho H+ vào muối tan thì CO32-
\[\xrightarrow{{}}\] HCO3-\[\xrightarrow{{}}\] H2O+
CO2.
Nếu cho H+ vào muối không
tan thì CO32- \[\xrightarrow{{}}\] CO2 + H2O.
+
Tác dụng với dung dịch bazơ \[\xrightarrow{{}}\]muối mới + bazơ mới
NaHCO3 + NaOH \[\xrightarrow{{}}\]
Na2CO3 + H2O
+ Tác dụng với muối \[\xrightarrow{{}}\] 2
muối mới
Na2CO3 + CaCl2 \[\xrightarrow{{}}\]
CaCO3 + 2NaCl
+ Tác dụng với kim loại đứng trước kim loại
tạo muối → muối mới + kim loại mới
Cu(HCO3)2 +
Mg \[\xrightarrow{{}}\] Mg(HCO3)2 + Cu
3. Nhận biết
Cho tác dụng với axit \[\xrightarrow{{}}\]
CO2
CaCO3 + 2HCl \[\xrightarrow{{}}\]CaCl2 + CO2 + H2O
PHẦN II) BÀI TẬP
Câu 1: Hoàn
thành các phương trình phản ứng sau
(a) CO + Cl2 (b) CO +CuO
(c) CO +O2 (d) CO + FeXOY
Câu 2: Trong
“khí than ướt” và “khí than khô” đều có chứa
A. CO2. B. CO C. H2 D. H2O
Câu 3: Phản
ứng dùng để điều chế CO trong phòng thí nghiệm là.
A. C + H2O 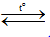 CO +H2.
CO +H2.
B. 2C +O2 \[\xrightarrow{{{t}^{o}}}\]2CO.
C. C + CO2 \[\xrightarrow{{{t}^{o}}}\]2CO.
D. HCOOH \[\xrightarrow{{{t}^{o}},{{H}_{2}}S{{O}_{4}}}\] CO + 2H2O
Câu 4: Oxit
nào sau đây không bị khử bởi CO
A. Fe2O3. B. MgO. C. ZnO. D. CuO.
Câu 5: Cho
khí CO đi qua ống sứ nung nóng đựng hỗn hợp gồm Al2O3,
MgO, Fe2O3, CuO thu được chất rắn Y. Thành phần của
Y là.
A. Al, Mg, Fe2O3,
CuO. B. Al2O3,
MgO, Fe, Cu.
C. Al, MgO, Fe, Cu. D. Al2O3,
Mg, Fe, Cu.
Câu 6: Ở
nhiệt độ cao, CO khử được tất cả oxit trong dãy nào sau đây.
A. CuO, Ag2O, PbO, Al2O3.
B. Fe2O3, CuO, ZnO,
PbO.
C. CuO, Fe3O4, Na2O,
PbO.
D. Al2O3, FeO,
CuO, NiO.
Câu 7:
Những kim loại nào sau đây có thể được điều chế từ oxit bằng phương
pháp nhiệt luyện nhờ chất khử CO?
A. Ba, Cu, Ca. B. Fe, Cu, Ni.
C. Pb, Mg, Fe. D. Fe, Ag, Al.
AA. CO + Na2O\[\xrightarrow{{}}\]2Na
+ CO2
BB. CO + MgO\[\xrightarrow{{}}\]Mg + CO2
CC. 3CO + Fe2O3\[\xrightarrow{{}}\]2Fe
+ 3CO2
DD. CO + K2CO3 + 2H2O\[\xrightarrow{{}}\]2KHCO3
+ H2
ACâu 9: Hợp chất nào sau đây có tính lưỡng tính:
A A. Na2CO3
B. NaHCO3
C. K2CO3 D. H2CO3
Câu 10: Cho chuỗi phản ứng sau:
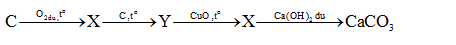
X và Y lần
lượt là:
A. CO ; CO2
B. CO2; Ca(HCO3)2
C. C; CO2 D. CO2 ;CO
Câu 11: Na2CO3
không phản ứng được với ;
A A. HCl B. HNO3 C. NaOH D. NaHSO4
Câu 12: Muối
nào không tan trong nước:
A. NaHKCO3 B. Na2CO3 C. CaCO3 D. (NH4)2CO3
Câu 13: Hoàn
thành các phương trình phản ứng sau:
A. KHCO3 + KOH\[\xrightarrow{{}}\]
B. HCO3 + HCl\[\xrightarrow{{}}\]
C. Na2CO3 + CO2
+H2O\[\xrightarrow{{}}\]
D. CaCO3 + CO2 + H2O\[\xrightarrow{{}}\]
Câu 14: Dung
dịch muối A có tính bazo, dung dịch muối B có môi trường trung tính, khi trộn
hai dung dịch trên có kết tủa. Hai dung dịch A, B có thể là:
A A. NaOH và K2CO3
B B. KOH và MgCl2
C C. K2CO3 và Ba(NO3)2
D D. K2CO3 và NaNO2
Câu 15: Nhiệt
phân hoàn toàn hỗn hợp chứa MgCO3 và CaCO3 có cùng số
mol, thu được khí X và chất rắn Y. Hòa tan chất rắn Y vào muối dư, lọc bỏ kết tủa
thu được dung dịch D. Hấp thụ hoàn toàn khí X vào bình chứa dung dịch D, sau phản
ứng trong bình có chứa:
A A. Mg(HCO3)2 B. MgCO3
và Mg(HCO3)2
C. CaCO3
và Ca(HCO3)2 D. Ca(HCO3)2
ĐÁP ÁN:

Câu 1:
a A. CO + Cl2\[\xrightarrow{{}}\]COCl2
b B. CO + CuO\[\xrightarrow{{}}\]Cu + CO2
c C. 2CO + O2\[\xrightarrow{{}}\]2CO2
d D. y CO + FeXOY\[\xrightarrow{{}}\]x
Fe + y CO2
Câu 13:
a A. KHCO3 + KOH\[\xrightarrow{{}}\]K2CO3
+ H2O
b B. HCO3 + HCl \[\xrightarrow{{}}\]KCl +
CO2 + H2O
c C. Na2CO3 + CO2 +H2O \[\xrightarrow{{}}\]2NaHCO3
d D. CaCO3 + CO2 + H2O \[\xrightarrow{{}}\]Ca(HCO3)2







