TÍNH CHẤT HÓA HỌC CỦA ANKEN
(olefin). Hiđrocacbon không no, mạch hở - CTTQ: CnH2n; n ³ 2
- Lý thuyết:
Trong phân tử anken có 1 lên kết đôi C = C, trong đó có 1 liên kết s bền và một liên kết p kém bền, dễ bị bẻ gãy khi tham gia phản ứng hoá học.
1. Phản ứng cộng:
a) Cộng H2 -> ankan:
CnH2n + H2 -> CnH2n+2
VD: C2H4 + H2 -> C2H6
b) Phản ứng cộng halogen (Cl2, Br2).
CnH2n + X2 -> CnH2nX2
VD: CH2 = CH2 + Cl2 -> CH2Cl – CH2Cl
CH3 – CH = CH – CH2 – CH3 + Br2 ® CH3 + CHBr – CHBr – CH2 – CH3
Lưu ý: Anken làm mất màu dung dịch nước brom nên người ta thường dùng nước brom hoặc dung dịch brom trong CCl4 làm thuốc thử để nhận biết anken.
c) phản ứng cộng HA (HA: HCl, HBr, H2SO4)
CnH2n + HA -> CnH2n+1A
VD: CH2 + CH2 + HCl ® CH3 –CH2Cl
CH2 = CH2 + H2SO4 ® CH3 – CH2 – OSO3H
Lưu Ý: Từ C3H6 trở đi phản ứng cộng theo qui tắc Maccopnhicop
.png)
d) Phản ứng cộng H2O ® ancol
VD: CH2 = CH2 + H2O -> CH3CH2OH
.png)
Qui tắc Maccopnhicop: Khi cọng một tác nhân bất đối xứng HA (H2O hoặc axit) vào liên kết đôi C = C của an ken thì sản phẩm chính được tạo thành do phần dương của tác nhân (H+) gắn vào cacbon có bậc thấp hơn, còn phần âm (A-) của tác nhân gắn vào C có bậc cao hơn.
2. Phản ứng trùng hợp:
nC=C -> [-C-C-]n
.png)
3. Phản ứng oxi hóa:
a) Phản ứng oxi hóa hoàn toàn:
.png)
VD: C2H4 + 3O2 -> 2CO2 + 2H2O
b) Oxi hóa không hoàn toàn:
- Dung dịch KMnO4 loãng ở nhiệt độ thường oxi hóa nối đôi của anken thành 1,2- diol.
3CnH2n + 2KMnO4 + 4H2O ® 3CnH2n(OH)2 + 2MnO2 + 2KOH
VD: 3CH2 = CH2 + 2KMnO4 + 4H2O ® 3CH2 -CH2 + 2MnO2 + 2KOH
(màu tím) │ │ (màu đen)
OH OH
Nhận xét: Dựa vào sự biến đổi màu của dung dịch KMnO4 (màu tím ®nhạt màu và có kết tủa đen) => phản ứng này được dùng để nhận ra sự có mặt của nối đôi, nối ba.
- OXH C2H4 ® CH3CHO
2CH2 = CH2 + O2 -> 2CH3CHO
4. Điều chế anken.
a) Đề hiđro ankan tương ứng:
CnH2n+2 -> CnH2n + H2
VD: C2H6 -> C2H4 + H2
b) Đề hiđrat hóa ancol tương ứng:
CnH2n+1OH -> CnH2n + H2O
C2H5OH -> C2H4 + H2O
.png)
c) Cộng H2 vào ankin (xt: Pd) hoặc ankadien (xt: Ni):
CnH2n-2 + H2 -> CnH2n
VD: CH ≡ CH + H2 -> CH2 = CH2
CH2 = CH – CH = CH2 -> CH3 – CH2 – CH =CH2
d) Loại HX ra khỏi dẫn xuất halogen của ankan tương ứng.
CnH2n+1X -> CnH2n + HX
VD: C2H5Cl -> C2H4 + HCl
e) Loại X2 ra khỏi dẫn xuất α,β-dihalogen của ankan tương ứng.
R – CHX – CHX – R’ + Zn -> R – CH = CH – R’ + ZnCl2
VD: CH2Br – CH2Br + Zn -> CH2 = CH2 + ZnBr2
- Bài tập mẫu:
Bài 1: Hãy tính số liên kết đơn, liên kết đôi giữa những nguyên tử cacbon trong phân tử các chất sau:
a) CH3 – CH3 ; b) CH2 = CH2 ; c) CH2 = CH – CH = CH2
Giải
CH3 – CH3
Có 1 liên kết đơn giữa hai nguyên tử cacbon C – C
CH2 = CH2
Có 1 liên kết đôi giữa hai nguyên tử cacbon C – C
CH2 = CH – CH2 = CH2
Có 1 liên kết đơn (C-C) và hai liên kết đôi ( C = C) trong phân tử chất
Bài 2:Hãy nêu phương pháp hoá học loại bỏ khí etilen có lẫn trong khí metan để thu được metan tinh khiết.
Giải:
Dẫn hỗn hợp khí qua bình đựng dung dịch brom dư, khí etilen phản ứng hết tạo thành đibrometan là chất lỏng ở trong dung dịch. Khí thoát ra là CH4.
CH2 = CH2 + Br2 → Br-CH2-CH2-Br
Bài 3: Để đốt cháy 4,48 lít khí etilen cần phải dùng :
a) Bao nhiêu lít oxi ?
b) Bao nhiêu lít không khí chứa 20% thể tích oxi ?
Biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Giải:
Số mol C2H4 = 4,48 : 22,4 = 0,2 mol
a) Phương trình phản ứng đốt cháy etilen:
C2H4 + 3O2 -tº→ 2CO2 + 2H2O
p.ư: 0,2 0,6 0,4 (mol)
VO2 =0,6 x 22,4 = 13,44 Jit
b)
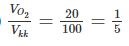
=> Vkk = 5
VO2 = 5 x 13,44 = 67,2 lít
C. Bài tập tự luyện
- Hiện tượng gì xảy ra khi dẫn khí C2H4 qua dd Br2. Viết PTHH.
- Chọn những câu đúng trong các câu sau:
a) CH4 làm mất màu dd brom
b) C2H4 tham gia phản ứng thế với clo tương tự CH4
c) CH4 và C2H4 đều có phản ứng cháy sinh ra CO2 và H2O
d) C2H4 tham gia phản ứng cộng với brom trong dd
e) CH4 và C2H4 đều có phản ứng trùng hợp
- Một hỗn hợp khí gồm C2H4 và CO2. Để thu khí C2H4 tinh khiết ta dùng hợp chất sau:
A) Ca(OH)2 dư B) dd Br2 dư C) dd HCl dư D) Tất cả đều sai
- Phản ứng cháy giữa etilen và oxi. Tỉ lệ giữa số mol CO2 và số mol H2O sinh ra là:
A) 1 : 1 B) 2: 1 C) 1:2 D) Kết quả khác
- Nhận biết 3 chất khí: CO2, CH4, C2H4 ?
- Đốt cháy V lít etylen, thu được 9g hơi nước. Hãy tính V và thể tích không khí cần dùng, biết O2 chiếm 20% thể tích không khí (đktc) ?
- Cho 2,8 lít hỗn hợp metan và etilen (đktc) lội qua dung dịch brom (dư), người ta thu được 4,7 gam đibrometan.
a) Viết phương trình phản ứng xảy ra.
b) Tính thành phần phần trăm của hỗn hợp theo thể tích.
- Cho 5,6 lít (đktc) hỗn hợp CH4 và C2H4 đi qua nước brom dư thấy có 4 g brom tham gia phản ứng.
- Viết phương trình phản ứng xảy ra ?
- Tính thành phần phần trăm thể tích mỗi chất đã dùng ?
- Tính thể tích O2 cần dùng để đốt cháy hoàn toàn hỗn hợp khí ban đầu ? (đktc)
- Đốt cháy hết 36 gam hh khí C3H6 và C2H6 trong O2 dư thu được 56 lít CO2 đktc
a) Tính V mỗi khí ở đktc
b) Tính % mỗi khí trong hh khí ban đầu
- Đốt cháy hoàn toàn 1,68 lít hỗn hợp gồm 2 khí CH4 và C2H4. Dẫn toàn bộ khí sinh ra qua bình đựng dd Ba(OH)2 dư thấy trong bình có 19,7g kết tủa.
a) Viết pthh ? b) Tính thành phần % thể tích mỗi khí trong hỗn hợp ?
c) Tính thể tích không khí đủ cho phản ứng cháy ? (đktc)
- Đốt cháy hoàn toàn 0,3 mol hỗn hợp gồm metan và etilen. Lấy toàn bộ CO2 sinh ra cho vào dd Ca(OH)2 dư thu được 40g kết tủa.
- Viết pthh xảy ra ?
- Tính % thể tích mỗi khí ban đầu ?







