AXIT NITRIC VÀ MUỐI NITRAT
A.LÝ THUYẾT:
I. AXIT NITRIC
1. Tính chất vật lí
- Là chất lỏng, không màu, tan tốt trong nước (C < 65%).
- Trong điều kiện thường, dung dịch có màu hơi vàng do HNO3 bị phân hủy chậm:
4HNO3 → 4NO2 + 2H2O + O2
→ phải đựng dung dịch HNO3 trong bình tối màu.
2. Tính chất hóa học
a. HNO3 là một axit mạnh
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với oxit bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
2HNO3 + CuO → Cu(NO3)2 + H2O
- Tác dụng với bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
- Tác dụng với muối (trong muối kim loại đã đạt hóa trị cao nhất) → muối mới + axit mới:
2HNO3 + CaCO3 → Ca(NO3)2 + CO2 + H2O
b. HNO3 là chất oxi hóa mạnh
- Tác dụng với kim loại:
+ HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
M + HNO3 → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
+ Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit. Thông thường thì dung dịch đặc → NO2, dung dịch loãng → NO; dung dịch axit càng loãng, kim loại càng mạnh thì N bị khử xuống mức càng sâu.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
Chú ý: Nếu cho Fe hoặc hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 mà sau phản ứng còn dư kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2+. HNO3 đặc nguội thụ động với Al, Fe, Cr.
- Tác dụng với phi kim → NO2 + H2O + oxit của phi kim.
C + 4HNO3 → CO2 + 4NO2 + 2H2O
S + 4HNO3 → SO2 + 4NO2 + 2H2O
P + 5HNO3 → H3PO4 + 5NO2 + H2O
- Tác dụng với các chất khử khác (oxit bazơ, bazơ và muối trong đó kim loại chưa có hóa trị cao nhất...).
4HNO3 + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3. Điều chế
- Trong công nghiệp: NH3 → NO → NO2 → HNO3
4NH3 + 5O2 → 4NO + 6H2O (Pt, 8500C)
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
- Trong phòng thí nghiệm
H2SO4 đặc + NaNO3 tinh thể → HNO3 + NaHSO4
4. Nhận biết
- Làm đỏ quỳ tím.
- Tác dụng với kim loại đứng sau H tạo khí nâu đỏ.
5. Ứng dụng
Axit nitric là một trong những hóa chất cơ bản và quan trọng. Phần lớn axit này được dùng để sản xuất phân đạm. Ngoài ra nó còn được dùng để sản xuất thuốc nổ, thuốc nhuộm, dược phẩm...
II. MUỐI NITRAT
1. Khái niệm và công thức tổng quát
- Muối amoni là muối của axit nitric.
- Công thức tổng quát: M(NO3)n.
2. Tính chất vật lí
Tất cả các muối nitrat đều tan và là các chất điện li mạnh:
M(NO3)n → Mn+ + nNO3-
3. Tính chất hóa học
a. Muối nitrat có các tính chất hóa học chung của muối
- Tác dụng với axit → muối mới + axit mới
Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
- Tác dụng với ddịch bazơ → muối mới + bazơ mới
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
- Tác dụng với dung dịch muối → 2 muối mới
Mg(NO3)2 + Na2CO3 → MgCO3 + 2NaNO3
- Tác dụng với kim loại có tính khử mạnh hơn kim loại trong muối → muối mới + kim loại mới.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
b. Muối nitrat dễ bị nhiệt phân
- Nếu muối nitrat của kim loại đứng trước Mg → muối nitrit và O2
M(NO3)n → M(NO2)n + n/2O2
ví dụ:
NaNO3 → NaNO2 + 1/2O2
- Nếu muối của kim loại trung bình (từ Mg đến Cu) → oxit kim loại + NO2 + O2
2M(NO3)n → M2On + 2nNO2 + n/2O2
ví dụ:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Nếu muối nitrat của kim loại sau Cu → kim loại + NO2 + O2
M(NO3)n → M + nNO2 + n/2O2
ví dụ:
AgNO3 → Ag + NO2 + 1/2O2
Chú ý: Một số muối nhiệt phân không theo quy luật trên như Fe(NO3)3, NH4NO3…
Nếu muối nitrat tồn tại trong môi trường axit thì cũng có tính oxi hóa mạnh như HNO3.
3Cu + 8HCl + 2KNO3 → 3CuCl2 + 2KCl + 2NO + 4H2O
4. Điều chế
Cho HNO3 phản ứng với kim loại, oxit kim loại, bazơ, muối bằng phản ứng trao đổi ion (muối trong đó kim loại giữ nguyên hóa trị) hoặc phản ứng oxi hóa khử (tạo muối kim loại có hóa trị cao).
5. Nhận biết
Dùng dung dịch HCl và mẩu Cu cho vào dung dịch cần nhận biết, nếu Cu tan tạo thành dung dịch màu xanh và có khí màu nâu đỏ bay ra thì đó là muối nitrat.
Cu + 4H+ + 2NO3- → Cu2+ + 2NO2 + 2H2O
B.BÀI TẬP VẬN DỤNG:
I.Bài tập lý thuyết:
Câu 1:Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2 B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc. D. NaNO2 và HCl đặc.
Câu 2: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa ?
A. ZnS + HNO3(đặc nóng) B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng) D. Cu + HNO3(đặc nóng)
Câu 3: Chỉ sử dụng dung dịch HNO3 loãng, có thể nhận biết được bao nhiêu chất rắn riêng biệt sau : MgCO3, Fe3O4, CuO, Al2O3 ?
A. 1. B. 2. C. 3. D. 4.
Câu 4: HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
A. NH3, Al2O3, Cu2S, BaSO4.
B. Cu(OH)2, BaCO3, Au, Fe2O3.
C. CuS,Pt, SO2, Ag.
D. Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Câu 5: Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2 , Pb(NO3)2. B. Ca(NO3)2 , Hg(NO3)2, AgNO3.
C. Zn(NO3)2, AgNO3, LiNO3. D. Hg(NO3)2 , AgNO3.
Câu 6: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm
A. FeO, NO2, O2. B. Fe2O3, NO2.
C. Fe, NO2, O2. D. Fe2O3, NO2 , O2.
Câu 7: Nhận định nào sau đây là sai ?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Câu 8: Có các mệnh đề sau :
(1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO có tính oxi hóa trong môi trường axit.
(3) Khi nhiệt phâm muối nitrat rắn ta đều thu được khí NO2
(4) Hầu hết muối nitrat đều bền nhiệt.
Trong các mệnh đè trên, những mệnh đề đúng là
- (1) và (3). B. (2) và (4). C. (2) và (3). D. (1) và (2).
II. Bài tập vận dụng:
Dạng 1: Kim loại + HNO3 :
Phương pháp giải:
- Khi cho nhiều kim loại tác dụng với cùng một dung dịch HNO3 cần nhớ: Kim loại càng mạnh tác dụng với dung dịch HNO3 càng loãng thì trong gốc NO3- bị khử xuống mức oxi hoá càng thấp
Nếu đề yêu cầu xác định thành phần hỗn hợp kim loại ban đầu có thể qua các bước giải:
- Bước 1: Viết các phương trình phản ứng xảy ra (chú ý xác định sản phẩm của nitơ cho đúng), nhớ cân bằng.
- Bước 2: Đặt ẩn số, thường là số mol của các kim loại trong hỗn hợp
- Bước 3: Lập hệ phương trình toán học để giải.
- Trường hợp bài toán không cho dữ kiện để lập phương trình đại số theo số mol và khối lượng các chất có trong phản ứng, để ngắn gọn ta nên áp dụng phương pháp bảo toàn electron.
- Cơ sở của phương pháp này là: dù các phản ứng oxi hoá - khử có xảy ra như thế nào nhưng vẫn có sự bảo toàn electron. Nghĩa là: Tổng số mol electron mà các chất oxi hoá thu vào.
- Phương pháp này sử dụng khi phản ứng xảy ra là phản ứng oxi hoá - khử đặc biệt đối với những trường hợp số các phản ứng xảy ra nhiều và phức tạp.
- Trước hết, ta phải nắm được thế nào là phản ứng oxi hoá - khử?
Phản ứng oxi hoá - khử là những phản ứng oxi hoá trong đó có sự cho và nhận electron, hay nói cách khác, trong phản ứng có sự thay đổi số oxi hoá của một số nguyên tố.Trong phản ứng oxi hoá - khử: tổng số electron do chất khử nhường phải đúng bằng tổng số electron mà chất oxi hoá nhận.
- Quá trình ứng với sự cho electron gọi là quá trình oxi hoá
- Quá trình ứng với sự nhận electron gọi là quá trình khử.
Từ đó suy ra: Tổng số mol electron do chất khử nhường bằng tổng số mol electron mà chất oxi hoá nhận. Đó chính là nội dung của định luật bảo toàn electron.
- Điều kiện để có phản ứng oxi hoá - khử: đó là chất oxi hoá mạnh phải tác dụng với chất khử mạnh tạo thành chất oxi hoá yếu hơn và chất khử yếu hơn.
- Khi giải toán mà phản ứng xảy ra là phản ứng oxi hoá - khử, nhất là khi số phản ứng xảy ra nhiều và phức tạp, chúng ta nên viết các quá trinh oxi hoá, các quá trình khử, sau đó vận dụng Định luật bảo toàn electron cho các quá trình này.
a. Axit phản ứng với Kim loại.
Bài 1. Hoà tan hoàn toàn 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí nitơ duy nhất (đktc). Xác định kim loại X?
A.Mg B. Cu C. Fe D. Al
Bài 2. Hòa tan 16,2 gam kim loại hoá trị III vào 5 lít dung dịch HNO3 0,5 M (D = 1,25g/ml). Sau khi phản ứng kết thúc thu được 2,8 lít hỗn hợp khí X gồm NO, N2 (0oC , 2 atm). Trộn hỗn hợp khí X với lượng oxi vừa đủ sau phản ứng thấy thể tích khí chỉ bằng 5/6 tổng thể tích X và oxi mới cho vào.
- Tìm kim loại đã dùng.
A. Cr B. Fe C. Al D. Co
b. Tính nồng độ % dung dịch HNO3 sau phản ứng.
A. 2,22% B. 2,52% B. 0,3024% D. 2,42%
Bài 3. Một hỗn hợp X gồm Fe, MgO hoà tan vừa đủ trong dung dịch HNO3 tạo ra 0,112 lít khí (đo ở 27,3oC; 6,6 atm) không màu dễ hoá nâu ngoài không khí. Cô cạn dung dịch thu được 10,22 gam hỗn hợp muối.
- Tính % theo khối lượng Fetrong hỗn hợp X.
A. %mFe = 3% B. %mFe = 36.2% C. %mFe = 55,38% D. %mFe = 4,53%
b. Tính thể tích dung dịch HNO3 0,8 M tham gia phản ứng.
A. 0,15 lít B. 0,025 lít C. 0,59 lít D. 0,335 lít
Bài 4. Hoà tan hoàn toàn 17,28 gam Mg vào dung dịch HNO3 thu được dung dịch A và 1,344 lít hỗn hợp khí X gồm N2 và N2O (ở 00C, 2 atm). Thêm một lượng dư KOH vào dung dịch A, đun nóng thì có một khí thoát ra. Khí này tác dụng vừa đủ với 200 ml dung dịch H2SO4 0,1M. Tính thể tích mỗi khí trong hỗn hợp X?
- VN2 = 2,24 lít và VN2O = 0,448 lít B. VN2 = 1,344 lít và VN2O = 1,344 lít
C. VN2 = 1,792 lít và VN2O = 0,896 lít D. VN2 = 1,12 lít và VN2O = 1,568 lít
Bài 5. Cho x mol Fe tác dụng với dung dịch chứa y mol HNO3 thu được khí NO duy nhất và dung dịch B. Biện luận quan hệ giữa x và y để trong dung dịch B biết B chỉ chứa một loại ion.
A . x = 0,25y B . x = y C. x = 0,75y D. Không xác định được
b. Axit phản ứng với hôn hợp Kim loại.
Bài 6. Xác định thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu (biết phản ứng tạo chất khử duy nhất là NO)?
- 0,8 lít B. 1 lít C. 1,2 lít D. 0,6 lít
Bài 7. Hoà tan hoàn toàn 0,368 gam hỗn hợp Al và Zn cần vừa đủ 25 lít dung dịch HNO3 có pH = 3. Sau phản ứng thu được dung dịch Avà không có khí thoát ra.
a.Tính khối lượng của Al trong hỗn hợp.
A. mAl = 0,108 gam B. mAl = 0,27 gam B. mAl = 0,135 gam và mZn = 0,233 gam D. mAl = 0,2025 gam
c. Thêm vào dung dịch A một lượng dư dung dịch NH3. Tính khối lượng kết tủa thu được.
Bài 8. Hỗn hợp X gồm Mg, Al, Zn có khối lượng 8,6 gam được chia làm 2 phần bằng nhau.
- Phần 1: đem đốt cháy hoàn toàn trong O2 dư thu được 7,5 gam hỗn hợp oxit.
- Phần 2: hoà tan trong dung dịch HNO3 đặc, nóng, dư được V lít (đktc) khí NO2 (sản phẩm khử duy nhất).
Xác định V?
- 17,92 lít B. 8,96 lít C. 4,48 lít D. 5,6 lít
Bài 9. Lấy m gam hỗn hợp X gồm Cu và Fe (có tỉ lệ khối lượng tương ứng là 7:3) phản ứng hoàn toàn với dung dịch chứa 44,1 gam HNO3; sau phản ứng còn lại 0,75 m gam chất rắn và 5,6 lít khí Y gồm NO và NO2(đkc). Tìm m?
A.50,4. B. 40,5. C. 44,8. D. 33,6.
Bài 10. Hỗn hợp M gồm 0,04 mol Fe và 0,06 mol Mg. Nếu đem hỗn hợp này hoà tan hoàn toàn trong dung dịch HNO3 dư được 0,03 mol sản phẩm khử X duy nhất và không có khí thoát ra . Nếu hoà tan hỗn hợp đó trong dung dịch H2SO4 đặc nóng dư cũng thu được 0,03 mol khí là sản phẩm khử duy nhất Y. X và Y lần lượt là những chất gì?
A.NO2 và SO2 B. NO2 và và H2S C. N2O4 và SO2 D. NH4NO3 và H2S
Dạng 2. Kim loại phản ứng với hỗn hợp HNO3 và H2SO4
Phương pháp giải:

Bài 1: Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và H2SO4 0,2M. Sau khi phản ứng hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất đktc). Tìm giá trị của V?
- 0,75 lít B. 1,792 lít C. 0,672 lít D. 0,448 lít
Bài 2: Hoà tan hoàn toàn m gam hỗn hợp X (Cu, Ag) trong dung dịch chứa HNO3 và H2SO4 thu được dung dịch Y chứa 7,06 gam muối và hỗn hợp khí Z chứa 0,05 mol NO2 và 0,01 mol SO2. Giá trị của m là?
- 3 gam B. 3,96 gam C. 6,1 gam D. 4,06 gam
Bài 3: Cho 12,9 gam hỗn hợp Al và Mg phản ứng với 100 ml dung dịch hỗn hợp HNO3 và H2SO4 thu được 0,1 mol mối khí SO2, NO, N2O. Cô cạn dung dịch thu được sau phản ứng được bao nhiêu gam muối khan?
- 77,8 gam B. 36 gam C. 35,1 gam D. 90,7 gam
Dạng 3: Chứng minh tính oxi hoá của NO3- – Kim loại phản ứng với muối nitrat trong môi trường axit
Phương pháp giải:
- Anion gốc nitrat NO3-
- Trong môi trường trung tính không có tính oxi hoá.
- Trong môi trường bazơ có tính oxi hoá yếu. (chẳng hạn : ion) NO3- trong môi trường kiềm có thể bị Zn, Al khử đến NH3.
Ví dụ :
8Al + 5NaOH + 3NaNO3 + 2H2O → 8NaAlO2 + 3NH3↑
Phương trình ion : 8Al + 5OH- + 2H2O + 3NO3- → 8AlO2- + 3NH↑
- Anion gốc nitrat NO3- trong môi trường axit có khả năng oxi hoá như HNO3. Chẳng hạn cho kim loại tác dụng với dung dịch hỗn hợp hai axit (H2SO4 loãng và HNO3) hay dung dịch hỗn hợp axit HCl, H2SO4 loãng và muối nitrat. Lúc này cần phải viết phương trình dưới dạng ion để thấy rõ vai trò chất oxi hoá của gốc NO3-.
Ví dụ :
Cho Cu vào dung dịch hỗn hợp NaNO3 và H2SO4 loãng sẽ xảy ra phản ứng giải phóng khí sau :
3Cu2+ + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
- Phương pháp chung để giải loại toán này là phải viết phương trình dạng ion có sự tham gia của ion NO3-. Sau đó so sánh số mol của kim loại M với tổng số mol H+ và tổng số mol NO3_ để xem chất hay ion nào đã phản ứng hết, rồi mới tính toán tiếp theo số mol của chất rắn phản ứng hết.
Bài 1. Cho 26,88 gam bột kim loại đồng hoà tan trong dung dịch HNO3 loãng, đựng trong một cốc. Sau khi kết thúc phản ứng, có 4,48 lít khí NO (đktc) thoát ra và còn lại m gam chất không tan. Thêm tiếp từ từ V ml dung dịch HCl 3,2M vào cốc để hoà tan vừa hết m gam chất không tan, có khí NO thoát ra (duy nhất). Xác định trị số của V?
- 50 ml B. 100 ml C. 150 ml D. 200 ml
Bài 5. Khuấy kỹ dung dịch chứa 13,6 gam AgNO3 với m gam bột Cu rồi thêm tiếp vào đó 100ml dung dịch H2SO4 (loãng) và đun nóng cho tới khi phản ứng xảy ra hoàn toàn thì thu được 9,28 gam bột kim loại, dung dịch A và khí NO. Lượng NaOH cần thiết để tác dụng hết với các chất trong dung dịch A là 0,325 mol.
a.Tính m gam và thể tích khí NO thu được ở đktc.
A. 3,2 gam B. 2,56 gam C. 10,88 gam D. 6,4 gam
b. Tính nồng độ mol/l của dd H2SO4 dùng . A. 1,5M B. 1,625M C. 2M D. 2,625M
Bài 6. Cho 5,8 gam FeCO3 tác dụng vừa đủ với dung dịch HNO3 được hỗn hợp hai khí không màu hoá nâu ngoài không khí và dung dịch X. Thêm dung dịch H2SO4 loãng dư vào X thì dung dịch thu được hoà tan tối đa m gam Cu biết rằng phản ứng tạo sản phẩm khử duy nhất là NO. Giá trị của m là?
- 16 gam B. 14,4 gam C. 1,6 gam D. 6,4 gam
Dạng 4. Bài toán tổng hợp axit nitric tác dụng với kim loại
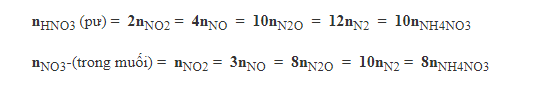
Bài 1. So sánh thể tích khí NO (duy nhất) thoát ra trong 2 thí nghiệm sau (các khí đo trong cùng điều kiện):
TN1: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1,0 mol/lít.
TN2: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1,0 mol/lít và H2SO4 0,5 mol/lít.
- V1 = V2 B. V1 > V2 C. V1 < V2 D. Không so sánh được
Bài 2. Nung x mol Fe trong không khí một thời gian thu được 16,08 gam hỗn hợp H gồm 4 chất rắn gồm Fe và 3 oxit của nó. Hòa tan hết lượng hỗn hợp H trên bằng dung dịch HNO3 loãng, thu được 672 ml khí NO duy nhất (đktc). Xác định trị số của x? A. 0,2 mol B. 0,21 mol C. 0,22 mol D. 0,23 mol
Bài 3. Cho 13,6 gam hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn X thu được bao nhiêu gam muối khan?
- 45,496 gam B. 33,84 gam C. 48,4 gam D. 36 gam
Bài 4. Hỗn hợp A gồm ba oxit sắt (FeO, Fe3O4, Fe2O3) có số mol bằng nhau. Hòa tan hết m gam hỗn hợp A này bằng dung dịch HNO3 thì thu được hỗn hợp K gồm hai khí NO2 và NO có thể tích 1,12 lit (đktc) và tỉ khối hỗn hợp K so với hiđro bằng 19,8. Trị số của m là ? A. 18,56 gam B. 13,92 gam C. 20,88 gam D. 23,2 gam
Bài 5. Cho 2,16 gam Mg tác dụng với dung dịch HNO3 dư. Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (đktc) và dung dịch X. Xác định khối lượng muối khan thu được khi cô cạn dung dịch X?
- 9,6 gam B. 13,92 gam C. 13,32 gam D. 8,88 gam







