Phương pháp quy đổi trong việc giải bài tập hóa học
I. Cơ sở lý thuyết
Khi quy đổi hỗn hợp nhiều chất (Ví dụ: hỗn hợp X gồm: Fe, FeO, Fe2O3 và Fe3O4 ...) (từ 3 chất trở lên) thành hỗn hợp 2 chất ( như: Fe, FeO hoặc Fe, Fe2O3...) một chất ( như: FexOy ) ta phải bảo toàn số mol nguyên tố và bảo toàn khối lượng hỗn hợp.
2) Có thể quy đổi hỗn hợp X về bất kỳ cặp chất nào, thậm chí quy đổi về một chất. Tuy nhiên ta nên chọn cặp chất nào đơn giản có ít phản ứng oxi hoá khử nhất, để đơn giản trong việc tính toán.
3) Trong quá trình tính toán theo phương pháp quy đổi đôi khi ta gặp số âm ( như số mol âm, khối lượng âm) đó là do sự bù trừ khối lượng của các chất trong hỗn hợp, trong trường hợp này ta vẫn tính toán bình thường và kết quả cuối cùng vẫn thoả mãn.
4) Khi quy đổi hỗn hợp X về một chất là FexOy thì Oxit FexOy tìm được chỉ là oxit giả định không có thực( ví dụ như: Fe15O16 , Fe7O8)
5) Khi quy đổi hỗn hợp các chất về nguyên tử thì tuân theo các bước như sau:
Bước 1: quy đổi hỗn hợp các chất về cac nguyên tố tạo thành hỗn hợp đó
Bước 2: đặt ẩn số thích hợp cho số mol nguyên tử các nguyên tố trong hỗn hợp.
Bước 3: Lập các phương trình dựa vào các định luật bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn electron
Bước 4: lập các phương trình dựa vào các giả thiết của bài toán nếu có.
Bước 5: giải các phương trình và tính toán để tìm ra đáp án.
6. Một số bài toán hoá học có thể giải nhanh bằng phương pháp bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn e song phương pháp quy đổi cũng tìm ra đáp án rất nhanh, chính xác và đó là phương pháp tương đối ưu việt, kết quả đáng tin cậy, có thể vận dụng vào các bài tập trắc nghiệm để phân loại học sinh (như đề tuyển sinh ĐH-CĐ - 2007 - 2008 mà Bộ giáo dục và đào tạo đã ra).
7. Công thức giải nhanh.
Khi gặp bài toán dạng sắt và hỗn hợp sắt ta áp dụng công thức tính nhanh sau: Khi áp dụng công thức này thì chúng ta cần chứng minh để nhớ và vận dụng linh hoạt trong quá ttrình làm các bài toán trắc nghiệm (công thức được chứng minh ở phương pháp bảo toàn e).
a. Trưuờng hợp 1: tính khối lượng sắt ban đầu trước khi bị ôxi hóa thành m gam hỗn hợp X gồm: Fe, FeO, Fe2O3, Fe3O4 .
${{m}_{Fe}}={{\frac{7.{{m}_{hh}}+56.{{n}_{e}}}{10}}_{{}}}_{{}}(1)$ ,
b. Trường hợp 2: tính khối lượng m gam hỗn hợp X gồm: Fe, FeO, Fe2O3, Fe3O4
${{m}_{hh}}={{\frac{10.{{m}_{Fe}}-56.{{n}_{e}}}{7}}^{{}}}^{{}}(2)$
c. Trưuờng hợp 3 : tính khối lượng muối tạo thành khi cho m gam hỗn hợp X gồm: Fe, FeO, Fe2O3, Fe3O4 vào dung dịch HNO3 nóng dưu
${{n}_{Fe{{(N{{O}_{3}})}_{3}}}}={{n}_{Fe}}=\frac{{{m}_{Fe}}}{56}=ymo{{l}_{,}}_{{}}{{m}_{Fe{{(N{{O}_{3}})}_{3}}}}=242.{{y}_{{}}}gam(3)$
d. Trưuờng hợp 4: tính khối lượng muối tạo thành khi cho m gam hỗn hợp X gồm: Fe, FeO, Fe2O3 ,Fe3O4 vào dung dịch H2SO4 đặc, nóng dưu
${{n}_{F{{e}_{2}}{{(S{{O}_{4}})}_{3}}}}=\frac{1}{2}.{{n}_{Fe}}=\frac{{{m}_{Fe}}}{112}={{x}_{{}}}mo{{l}_{,}}_{{}}{{m}_{F{{e}_{2}}{{(S{{O}_{4}})}_{3}}}}=400.{{x}_{{}}}gam(4)$
Ii. Bài toán áp dụng:
Bài toán 1: (Trích đề thi tuyển sinh ĐH CĐ Khối B- 2008) Nung m gam bột sắt trong oxi thu đựơc 3 gam hỗn hợp chất rắn X. Hoà tan hết hỗn hợp X trong dung dịch HNO3 dư thoát ra 0.56 lít NO (đktc) là sản phẩm khử duy nhất. Giá trị m là:
A. 2.52 gam B. 1.96 gam. C. 3.36 gam. D. 2.10 gam.
Bài giải:
Cách 1: Quy hỗn hợp chất rắn X về hai chất Fe, Fe2O3
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,025mol 0,025mol
${{n}_{NO}}=\frac{0,56}{22,4}=0,025mol$
${{m}_{F{{e}_{2}}{{O}_{3}}}}$= 3 - 0,025 .56 = 1,6gam ${{n}_{Fe(trong\,F{{e}_{2}}{{O}_{3}})}}=2.\frac{1,6}{160}=0,02mol$
mFe = 56(0,025 + 0,02) = 2,52 gam A đúng
Chú ý: Nếu ${{n}_{Fe(trong\,F{{e}_{2}}{{O}_{3}})}}=\frac{1,6}{160}=0,01mol$ị mFe = 56.(0,035) = 1,96g B sai
Cách 2: Quy hỗn hợp chất rắn X về hai chất FeO, Fe2O3
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
3.0,025 0,025
mFeO = 3.0,025 . 72 = 5,4g ${{n}_{Fe(FeO)}}=\frac{5,4}{72}=0,075mol$
${{m}_{F{{e}_{2}}{{O}_{3}}}}$ = 3 - 5,4 = -2,4g
${{n}_{Fe(F{{e}_{2}}{{O}_{3}})}}=\frac{2.(-2,4)}{160}=-\frac{4,8}{160}=-0,03mol$
mFe = 56 .(0,075 + (-0,03)) = 2,52 gam A đúng
Chú ý: + Kết quả âm ta vẫn tính bình thường vì đây là phương pháp quy đổi
+ Nếu ${{n}_{Fe}}{{_{(}}_{F{{e}_{2}}{{O}_{3}}}}_{)}=-0,015mol$ mFe = 56.0,06 = 3,36g C sai
Cách 3: Quy hỗn hợp chất rắn X về mặt chất là Fex Oy
3FexOy + (12x - 2y)HNO3 → 2Fe(NO3)3 +(3x-2y)NO + (6x -y)H2O
$\frac{3.0,025}{3x-2y}$ 0,025mol
${{n}_{F{{e}_{x}}{{O}_{y}}}}=\frac{3}{56x+16y}=\frac{3.0,025}{3x-2y}\,\,$ Û $\frac{x}{y}=\frac{3}{2}\,\Rightarrow \,{{m}_{F{{e}_{3}}{{O}_{2}}}}=200$
${{m}_{Fe(oxit)}}=\frac{3.56.3}{200}=2,52g$ A đúng
Chú ý: Nếu ${{m}_{F{{e}_{2}}{{O}_{3}}}}=160\,\Rightarrow \,{{m}_{Fe}}={}^{3.2.56}/{}_{160}=2,1g$ D sai
Cách 4: áp dụng công thức giải nhanh.
${{m}_{Fe}}=\frac{7.{{m}_{hh}}+56.{{n}_{e}}}{10}=\frac{7.3+56.0,025.3}{10}=2,52gam$ => A đúng
Bài toán 2: ( Trích đề thi tuyển sinh ĐH CĐ- Khối A- 2010). Cho 11.36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 1.344 lít khí NO (sản phẩm khử duy nhất ở dktc) và dung d?ch X. Cô cạn dung dịch X sau phản ứng được m gam muối khan. Giá trị m là:
A. 34.36 gam. B. 35.50 gam. C. 49.09 gam D. 38.72 gam.
Cách 1: Quy đổi hỗn hợp về hai chất: Fe, Fe2O3
Hoà tan hỗn hợp với HNO3 loãng dư 1,344 lít NO
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
0,06mol 0,6mol 0,06mol
Fe2O3 → 2Fe(NO3)3 (2)
0,05 0,1mol
${{n}_{NO}}=\frac{1,344}{22,4}=0,06mol;\,\,$
Từ (1) mFe = 56 . 0,06 = 3,36 g ${{m}_{F{{e}_{2}}{{O}_{3}}}}=11,36-3,36=8g$
${{n}_{F{{e}_{2}}{{O}_{3}}}}=\frac{8}{160}=0,05mol$ mX = 242 (0,06 + 0,1) = 38,72g D đúng
Cách 2: Quy hỗn hợp về hai chất: FeO, Fe2O3
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
0,18 0,18mol 0,06
Fe2O3 → 2Fe(NO3)3
-0,01 -0,02
mFeO = 12,96g; ị ${{m}_{F{{e}_{2}}{{O}_{3}}}}=-1,6g$
${{m}_{Fe(N{{O}_{3}})}}_{3}=242(0,18+0,02)=38,72g$ đ D đúng
Cách 3: Quy hỗn hợp về một chất FexOy
3FexOy + (12x - 2y)HNO3 → 3xFe(NO3)3 + (3x - 2y)NO + (6x-y)H2O
$\frac{3.0,06}{3x-2y}$ $\frac{3.x.0,06}{3x-2y}$ 0,06
${{n}_{F{{e}_{x}}{{O}_{y}}}}=\frac{11,36}{56x+16y}=\frac{0,06.3}{3x-2y}$ 150x = 160y $\frac{x}{y}=\frac{16}{15}$
${{m}_{Fe{{(N{{O}_{3}})}_{3}}}}=\frac{3.16.0,06}{3.16-2.15}.242=38,72g$ D đúng
Cách 4. áp dụng phương pháp quy đổi nguyên tử
Ta xem 11.36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 là hỗn hợp của x mol Fe và y mol O. Ta có: mHH =56x+16y =11,36 (1).
Mặt khác quá trình cho và nhận electron như sau
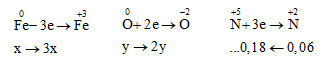
áp dụng ĐLBT E ta được:
${{n}_{e}}=2y+0,18=3x,=>3x-2y=0,{{18}_{{}}}{{_{{}}}_{{}}}(2)\,\,$
Giải hệ (1) và (2) => x=0,16 mol, y=0,15 mol.
${{n}_{Fe{{(N{{O}_{3}})}_{3}}}}={{n}_{Fe}}=x=0,16mo{{l}_{,}}=>{{m}_{Fe{{(N{{O}_{3}})}_{3}}}}=0,16.242=38,72gam$, D đúng
Cách 5: áp dụng công thức giải nhanh.
.png)
Cách 6. Lấy các đáp án đem chia cho khối lượng mol của muối là 242 thì các số đều lẽ nhưng chỉ có đáp án D là số không lẽ là 0,16
Bài toán 3: Nung 8.4 gam Fe trong không khí, sau phản ứng thu được m gam X gồm Fe, FeO, Fe2O3 và Fe3O4 . Hoà tan m gam hỗn hợp X bằng HNO3 dư, thu được 2.24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị m là:
A. 11.2 gam. B. 25.2 gam. C. 43.87 gam D. 6.8 gam.
Bài giải.
- Cách 1: + Sử dụng phương pháp quy đổi,
Quy đổi hỗn hợp X về hai chất Fe và Fe2O3 hoà tan hỗn hợp X vào dung dịch HNO3 dư ta có:
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O: ${{n}_{N{{O}_{2}}}}=0,1mol$
0,1/3 0,1
Số mol của nguyên tử Fe tạo oxit Fe2O3 là:
${{n}_{Fe}}=\frac{8,4}{56}-\frac{0,1}{3}=\frac{0,35}{3}(mol)$ ị ${{n}_{F{{e}_{2}}{{O}_{3}}}}=\frac{1}{2}{{n}_{Fe}}=\frac{0,35}{2.3}$
.png)
Chú ý:
+ Nếu ${{n}_{F{{e}_{2}}{{O}_{3}}}}={{n}_{Fe}}=\frac{0,35}{3}\,\Rightarrow \,{{m}_{X}}=\frac{0,35}{3}(56+160)=25,2g$ B sai
+ Nếu ${{n}_{F{{e}_{2}}{{O}_{3}}}}=2{{n}_{Fe}}=2.\frac{0,35}{3}\,\Rightarrow \,{{m}_{X}}=\frac{0,35}{3}(56+320)=43,87g$đ C sai
+ Nếu không cân bằng pt : ${{n}_{Fe}}={{n}_{N{{O}_{2}}}}=0,1mol\,\Rightarrow \,{{n}_{Fe}}=\frac{8,4}{56}-0,1=0,05mol$
mX = 0,05 (56 + 80) = 6,8 D sai
Tất nhiên mX > 8,4 do vậy D là đáp án vô lý)
- Cách 2: Quy đổi hổn hợp X về hai chất FeO và Fe2O3
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
0,1 0,1
.png)
Chú ý: Vẫn có thể quy đổi hỗn hợp X về hai chất (FeO và Fe3O4) hoặc (Fe và FeO) hoặc (Fe và Fe3O4) nhưng việc giải trở nên phức tạp hơn, cụ thể là ta phải đặt ẩn số mol mỗi chất, lập hệ phương trình, giải hệ phương trình hai ẩn số).
Cách 3: Quy hỗn hợp X về một chất FexOy:
FexOy + (6x - 2y) HNO3 → xFe(NO3)3 + (3x - 2y) NO2 + (3x -y) H2O
$\frac{0,1}{3x-2y}$mol 0,1mol
áp dụng định luật bảo toàn nguyên tố sắt: ${{n}_{Fe}}=\frac{8,4}{56}=\frac{0,1.x}{3x-2y}\,\Rightarrow \,\frac{x}{y}=\frac{6}{7}$
Vậy công thức quy đổi là: Fe6O7 (M = 448) và ${{n}_{F{{e}_{6}}{{O}_{7}}}}=\frac{0,1}{3.6-2.7}=0,025mol$
mX = 0,025 . 448 = 11,2g A đúng
Nhận xét: Quy đổi hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 về hỗn hợp hai chất FeO, Fe2O3 là đơn giản nhất.
Cách 4: áp dụng công thức giải nhanh.
${{m}_{Fe}}=\frac{7.{{m}_{hh}}+56.{{n}_{e}}}{10}=>{{m}_{hh}}=\frac{10.{{m}_{Fe}}-56.{{n}_{e}}}{7}$ trong đó mFe là khối lượng sắt, mhh là khối lượng của hỗn hợp các chất rắn sắt và ôxit sắt, ne là số mol e trao đổi. Công thức này được chứng minh trong các phương pháp bảo toàn e..
Ta có; ${{m}_{hh}}=\frac{10.{{m}_{Fe}}-56.{{n}_{e}}}{7}=\frac{10.8,4-56.0,1.}{7}=11,2gam$ =>A đúng
Bài toán 4: Nung m gam Fe trong không khí, sau một thời gian ta thu được 11,2 gam hỗn hợp chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hoà tan hết 11,2g hỗn hợp chất rắn X vào dung dịch HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị m là:
A: 7,28gam B: 5,6gam C: 8,40gam D: 7,40gam
Bài giải:
Cách 1: Tương tự như ví dụ 1, đối với cách 1
- Quy về hỗn hợp X về hai chất Fe và Fe2O3:
.png)
Số mol của nguyên tử Fe tạo oxit Fe2O3 là:
${{n}_{Fe}}=\left( \frac{m}{56}-\frac{0,1}{3} \right)mol\,\Rightarrow \,{{n}_{F{{e}_{2}}{{O}_{3}}}}=\frac{1}{2}\left( \frac{m}{56}-\frac{0,1}{3} \right)$
Vậy mX = mFe + ${{m}_{F{{e}_{2}}{{O}_{3}}}}$ Û $11,2=56.\frac{0,1}{3}+\frac{1}{2}\left( \frac{m}{56}-\frac{0,1}{3} \right).160$ ị m = 8,4 đ C đúng
Cách 2: Tương tự cách 2 quy đổi hỗn hợp X về FeO và Fe2O3 m = 8,4 g
Cách 3: Tương tự cách 3 quy đổi hỗn hợp X về FexOy m = 8,4 g
Cách 4: áp dụng công thức giải nhanh.
${{m}_{Fe}}=\frac{7.{{m}_{hh}}+56.{{n}_{e}}}{10}=\frac{7.11,2+56.0,1}{10}=8,4gam$ => C đúng
Bài toán 5: Hoà tan hết m gam hỗn hợp X gồm Fe, Fe2O3, Fe3O4 trong dung dịch HNO3 đặc nóng thu được 4,48 lít khí màu nâu duy nhất (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2gam muối khan, giá trị m là:
A: 78,4g B: 139,2g C: 46,4g D: 46,256g
Bài giải:
áp dụng phương pháp quy đổi: Quy hỗn hợp X về hỗn hợp hai chất
Cách 1: Quy hỗn hợp X về 2 chất Fe và Fe2O3:
Hoà tan hỗn hợp X vào dung dịch HNO3 đặc nóng dư.
Ta có: Fe + 6HNO3 → Fe(NO3)3 + 3NO2ư + 3H2O (1)
0,2/3 0,2/3 0,2
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O (2)
Ta có: ${{n}_{N{{O}_{2}}}}=\frac{4,48}{22,4}=0,2mol$; ${{n}_{mu\grave{e}i khan}}={{n}_{Fe{{(N{{O}_{3}})}_{3}}}}=\frac{145,2}{242}=0,6mol$
Từ pt (2): .png)
Nếu ${{m}_{{{h}^{2}}X}}={{m}_{Fe}}+{{n}_{F{{e}_{2}}{{O}_{3}}}}=0,66.56+0,266.160=46,256g$ D sai
Cách 2: Quy hỗn hợp X về hỗn hợp 2 chất FeO và Fe2O3 ta có:
.png)
${{n}_{Fe{{(N{{O}_{3}})}_{3}}}}=\frac{145,2}{242}=0,6mol$, mX = 0,2 (72 + 160) = 46,4gam → C đúng
Chú ý: + Nếu từ (4) không cân bằng ⇒ ${{n}_{F{{e}_{2}}{{O}_{3}}}}=0,4mol$
mX = 0,2 (72 + 2 . 160) = 78,4 gam → A sai
Cách 3: Quy hỗn hợp X về một chất là FexOy:
FexOy + (6x -2y) HNO3 → xFe(NO3)3 + (3x - 2y)NO2 + (3x - y) H2O
${}^{0,2}/{}_{3x-2y}$ 0,6 0,2
áp dụng định luật bảo toàn nguyên tố Fe: $\frac{0,2}{3x-2y}=\frac{0,6}{x}$Û 6y= 8x
$\frac{x}{y}=\frac{3}{4}$ ị Fe3O4 → ${{m}_{{{h}^{2}}}}=\frac{0,2}{3.3-4.2}.232=46,4g$ → C đúng
Chú ý: + Nếu mhh = 0,6 ´ 232 = 139,2 g → B sai
Cách 4: áp dụng công thức giải nhanh.
${{n}_{Fe}}={{n}_{Fe{{(N{{O}_{3}})}_{3}}}}=\frac{145,2}{242}=0,6mol$ => mFe = 0,6.56=33,6 gam
${{m}_{hh}}=\frac{10.{{m}_{Fe}}-56.{{n}_{e}}}{7}=\frac{10.33,6-56.0,2}{7}=46,4gam$ => C đúng
Bài toán 6: Hoà tan hoàn toàn 49.6 gam hh X gồm Fe, FeO, Fe2O3 và Fe3O4 bằng H2SO4 đặc, nóng thu được dung dịch Y và 8.96 lít khí SO2(đktc). Thành phần phần trăm về khối lượng của oxi trong hỗn hợp X và khối lượng muối trong dung dịch Y lần lượt là:
A. 20.97% và 140 gam. B. 37.50% và 140 gam.
C. 20.97% và 180 gam D.37.50% và 120 gam.
Bài giải:
Cách 1: + Quy hỗn hợp X về hai chất FeO và Fe2O3 ta có:
.png)
Cách 2. áp dụng phương pháp quy đổi nguyên tử
Ta xem 49,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 là hỗn hợp của x mol Fe và y mol O. Ta có: mHH =56x+16y =49,6 (1).
Mặt khác quá trình cho và nhận electron như sau
.png)
áp dụng ĐLBT E ta được:
${{n}_{e}}=2y+0,18=3x,=>3x-2y=0,{{8}_{{}}}{{_{{}}}_{{}}}(2)\,\,$
Giải hệ (1) và (2) => x=0,7 mol, y=0,65 mol.
.png)
Cách 3: áp dụng công thức giải nhanh.
.png)
Bài toán 7: Để khử hoàn toàn 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3, cần 0,05 mol H2. Mặt khác hoà tan hoàn toàn 3,04 gam hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được thể tích V ml SO2 (đktc). Giá trị V(ml) là:
A.112 ml B. 224 ml C. 336 ml D. 448 ml.
Bài giải:
Cách 1:
Quy đổi hỗn hợp X về hỗn hợp hai chất FeO và Fe2O3 với số mol là x, y
Ta có: $FeO+{{H}_{2}}\,\xrightarrow{{{t}^{0}}}Fe+{{H}_{2}}O$ (1)
x x x
Fe2O3 + 3H2 → 2Fe + 3H2O (2)
y 3y 2y
.png)
2FeO + 4 H2SO4 → Fe2(SO4)3 + SO2 + 4H2O (3)
0,02mol 0,01mol
Vậy ${{V}_{S{{O}_{2}}}}=$0,01 ´ 22,4 = 0,224 lít hay 224ml → B đúng
Chú ý: Nếu (3) không cân bằng: ${{V}_{S{{O}_{2}}}}$= 0,02 . 22,4 = 0,448 lít = 448ml →D sai
Cách 2: áp dụng công thức giải nhanh.
${{n}_{O}}={{n}_{H2}}=0,05mol,{{m}_{O}}=0,05.16=0,8gam$ mFe = môxit – mO =2,24 gam => ${{n}_{e}}=\frac{10.22,4-7.3,04}{56.2}=0,01mol,Vs{{o}_{2}}=0,01.22,4=0,224lit=224ml$ đ B đúng
Bài toán 8: H?n h?p X gồm Fe, FeO, Fe2O3 và Fe3O4 với số mol mỗi chất là 0.1 mol hoà tan hết vào dung dịch Y gồm ( HCl, H2SO4 loãng) dư thu được dung dịch Z. Nhỏ từ từ dung dịch Cu(NO3)2 1M vào dd Z cho tới khi ngừng thoát khí NO. Thể tích dung dịch Cu(NO3)2 cần dùng và thể tích khí thoát ra ở đktc thuộc phương án nào:
A. 50 ml và 6.72 lít B. 100 ml và 2.24 lít.
C. 50 ml và 2.24 lít D. 100 ml và 6.72 lít.
Bài giải:
Quy hỗn hợp 0,1 mol Fe2O3 và 0,1 mol FeO thành 0,1 mol Fe3O4
Hỗn hợp X gồm: Fe3O4 mol: Fe(0,2mol) + dung dịch Y
Fe3O4 + 8H+ → Fe2+ + 2Fe3+ + 4H2O (1)
0,2mol 0,2 0,4mol
Fe + 2H+ → Fe2+ + H2ư (2)
0,1 0,1
D2 Z (Fe2+: 0,3mol; Fe3+: 0,4mol) + Cu(NO3)2 (3)
$3F{{e}^{2+}}+NO_{3}^{-}+4{{H}^{+}}\,\,\to \,3F{{e}^{3+}}+NO\uparrow +2{{H}_{2}}O$ (4)
0,3 0,1 0,1
VNO = 0,1 ´ 22,4 = 2,24 lít; ${{n}_{Cu{{(N{{O}_{3}})}_{2}}}}=\frac{1}{2}{{n}_{NO_{3}^{-}}}=0,05mol$
${{n}_{{{d}^{2}}Cu{{(N{{O}_{3}})}_{2}}}}=\frac{0,05}{1}=0,05$lít (hay 50ml) đ C đúng
.png)
+ Từ (4) nếu không cần bằng: VNO = 0,3 ´ 22,4 = 6,72 lít → A sai
Bài toán 9: Nung x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp chất rắn. Hoà tan hoàn toàn hỗn hợp chất rắn trên bằng H2SO4 đặc, nóng, dư thu được dung dịch Y và 6,72 lít khí SO2(đktc). Giá trị của x mol là:
A. 0,7 mol B. 0,3 mol C. 0,45 mol D. 0,8 mol
Bài giải.
Xem hỗn hợp chất rắn là hỗn hợp của x mol Fe , 0,15 mol Cu và y mol O.
Ta có: mHH=56x + 64.0,15 +16y=63,2
56x+16y=53,6 (1)
Mặt khác quá trình cho và nhận electron như sau
.png)
áp dụng ĐLBT E ta được:
${{n}_{e}}=3x+0,3=0,6+2y,=>3x-2y=0,{{3}_{{}}}{{_{{}}}_{{}}}(2)\,\,$
Giải hệ (1) và (2) => x=0,7 mol, y=0,9 mol. A đúng
Bài toán 10. Hoà tan hết m gam hỗn hợp X gồm Fe, FeS , FeS2, và S bằng HNO3 nóng dư thu được 9,072 lít khí màu nâu duy nhất (dktc, sản phẩm khư duy nhất ) và dung dịch Y. Chia dung dịch Y thành 2 phần bằng nhau.
Phần 1 cho tác dụng với dung dịch BaCl2 dư thu được 5,825 gam kết tủa trắng.
Phần 2 tan trong dung dịch NaOH dư thu được kết tủa Z, nung Z trong không khí đến khối lượng không đổi được a gam chất rắn.
Giá trị của m và a lần lượt là:
A. 5,52 gam và 2,8 gam. B. 3,56 gam và 1,4 gam.
C. 2,32 gam và 1,4 gam D. 3,56 gam và 2,8 gam.
Bài giải.
Xem hỗn hợp chất rắn X là hỗn hợp của x mol Fe u và y mol S.
Quá trình cho và nhận electron như sau
.png)
áp dụng ĐLBT E ta được:
${{n}_{e}}=3x+6y={{n}_{N{{O}_{2}}}}=\frac{9,072}{22,4}=0,405mol,=>3x+6y=0,{{405}_{{}}}{{_{{}}}_{{}}}(1)\,\,$
Mặt khác trong 1/2 dung dịch Y:
.png)
Thay vào (1) ta được x=0,035 mol
m = mX=56x+32y=56.0,035+32.0,05=3,56 gam
$a={{m}_{F{{e}_{2}}{{O}_{3}}}}=\frac{x}{4}.160=\frac{0,035}{4}.160=1,4gam$ => B đúng
iii. bài tập tự giải
Bài 1: Hoà tan hết m gam hỗn hợp X gồm FeO, Fe2O3 và Fe3O4 bằng HNO3 thu được 2.24 lít khí màu nâu duy nhất (dktc). Cô cạn dung dịch sau phản ứng được 96.8 gam muối khan. Giá trị m là:
A. 55.2 gam. B. 31.2 gam. C. 23.2 gam D. 46.4 gam.
Bài 2: Hoà tan 52.2 gam hh X gồm FeO, Fe2O3 và Fe3O4 bằng HNO3 đặc, nóng thu được 3.36 lít khí NO2 (dktc). Cô cạn dd sau phản ứng được m gam muối khan. Giá trị m là:
A. 36.3 gam. B. 161.535 gam. C. 46.4 gam D. 72.6 gam.
Bài 3: Vào thế kỷ XVII các nhà khoa học đã lấy được một mẩu sắt nguyên chất từ các mảnh vỡ của thiên thạch. Sau khi đem về phòng thí nghiệm do bảo quản không tốt nên nó bị oxi hóa thành m gam chất rắn X gồm Fe và các ôxit của nó. Để xác định khối lượng của mẩu sắt thì các nhà khoa học đã cho m gam chất rắn X trên vào vào dung dịch HNO3 loãng thu được khí NO duy nhất và dung dịch muối Y, cô cạn dung dịch muối Y cân nặng 48,4 gam chất rắn khan. Mẩu thiên thạch bằng sắt nguyên chất đó có khối lượng là:
A. 11,2gam. B. 5,6 gam C. 16,8 gam D. 8,4 gam
Bài 4: Vào thế kỷ XIX các nhà khoa học đã lấy được một mẩu sắt nguyên chất từ các mảnh vỡ của thiên thạch. Sau khi đem về phòng thí nghiệm các nhà khoa học đã lấy 2,8 gam Fe để trong ống thí nghiệm không đậy nắp kín nó bị ôxi hóa thành m gam chất rắn X gồm Fe và các ôxit của nó. Cho m1 gam chất rắn X trên vào vào dung dịch HNO3 loãng thu được 896 ml khí NO duy nhất (đktc) và dung dịch muối Y, cô cạn dung dịch muối Y cân nặng m2 gam chất rắn khan.
1. giá trị của m2 là:
A. 72,6 gam B. 12,1 gam. C. 16,8 gam D. 72,6 gam
2. giá trị của m1 là:
A. 6,2gam. B. 3,04 gam. C. 6,68 gam D. 8,04 gam
Bài 5: một chiếc kim bằng sắt lâu ngày bị oxi hóa, sau đó người ta cân được 8,2 gam sắt và các ôxit sắt cho toàn bộ vào dung dịch HNO3 đặc nóng thu được 4,48 lít khí màu nâu duy nhất (đktc) và dung dịch muối Y, cô cạn dung dịch muối Y thu được m gam muối khan.
1. khối lượng chiếc kim bằng sắt là:
A. 6,86 gam. B. 3,43 gam. C. 2,42 gam D. 6.26 gam
2. giá trị của m gam muối là:
A. 29,645 gam. B. 29,5724 gam. C. 31,46 gam D. 29,04 gam
Bài 6: Các nhà khoa học đã lấy m1 gam một mảnh vỡ thiên thach bằng sắt nguyên chất do bảo quản không tốt nên nó bị oxi hóa thành m2 gam chất rắn X gồm Fe và các ôxit của nó. Để xác định khối lượng của mẩu sắt thì các nhà khoa học đã cho m2 gam chất rắn X trên vào vào dung dịch HNO3 loãng dư thu được 6,72 lít khí NO duy nhất(đktc) và dung dịch muối Y, cô cạn dung dịch muối Y cân nặng 121 gam chất rắn khan.
1. giá trị của là: m1
A. 28 gam B. 56 gam. C. 84 gam D. 16,8 gam
2. giá trị của m2 là:
A. 32,8 gam. B. 65,6 gam. C. 42,8 gam D. 58,6 gam
Bài 7: các nhà thám hiểm đã tìm thấy một chất rắn bị gĩ sắt dưới đại dương, sau khi đưa mẩu gỉ sắt để xác định khối lượng sắt trước khi bị oxi hóa thì người ta cho 16 gam gĩ sắt đó vào vào dung dịch HNO3 đặc nóng dư thu được 3,684 lít khí NO2 duy nhất(đktc) và dung dịch muối X, cô cạn dung dịch muối X cân nặng m gam chất rắn khan.
1. khối lượng sắt ban đầu là:
A. 11,200 gam B. 12,096 gam. C. 11,760 gam D. 12,432 gam
2. giá trị của m là:
A. 52,514 gam. B. 52,272 gam. C. 50,820 gam D. 48,400 gam
Bài 8: cho 12,096 gam Fe nung trong không khí thu được m1 gam chất rắn X gồm Fe và các ôxit của nó. Cho m1 gam chất rắn X trên vào vào dung dịch H2SO4 đặc nóng thu được 1,792 lít khí SO2 duy nhất (đktc) và dung dịch muối Y, cô cạn dung dịch muối Y cân nặng m2 gam chất rắn khan.
1. giá trị của m1 là:
A. 14 gam B. 16 gam. C. 18 gam D. 22,6 gam
2. giá trị của m2 là:
A. 43,6 gam. B. 43,2 gam. C. 42,0 gam D. 46,8 gam
Bài 9: Sau khi khai thác quặng bôxit nhôm có lẫn các tạp chất: SiO2, Fe, các oxit của Fe. Để loại bỏ tạp chất người ta cho quặng vào dung dịch NaOH đặc nóng dư thu được dung dịch X và m gam chất rắn không tan Y. để xác định m gam chất rắn không tan chiếm bao nhiêu phần trẩmtng quặng ta cho m gam chất rắn đó vào dung dịch HNO3 loãng dư thu được 6,72 lít khí NO duy nhất(đktc) và dung dịch muối Y, cô cạn dung dịch muối Y cân nặng 121 gam chất rắn khan. Giá trị của là m1
A. 32,8 gam B. 34,6 gam. C. 42,6 gam D. 36,8 gam
Bài 10: Hòa tan hoàn toàn một ôxit sắt FexOy bằng dung dịch H2SO4 đặc nóng thu được 2,24 lít khí SO2 duy nhất (đktc) và dung dịch muối Y, cô cạn dung dịch muối Y cân nặng 120 gam chất rắn khan. Công thức phân tử của ôxit sắt là:
A. FeO B. Fe2O3 C. Fe3O4 D. Không xác định được
Bài 11: Nung y mol Fe trong không khí một thời gian thu được 16,08 gam hỗn hợp A gồm 4 chất rắn gồm Fe và các ôxit sắt. hòa tan hết lượng hỗn hợp A trên bằng dung dịch HNO3 loãng dư thu được 672 ml khí NO duy nhất(đktc) và dung dịch muối. Giá trị của là y:
A. 0.21 mol B. 0,232 mol. C. 0,426 mol D. 36,8 mol
Bài 12: Hòa tan m gam hỗn hợp X bốn chất rắn gồm Fe và các ôxit sắt bằng dung dịch HNO3 dư thu được 4,48 lit khí NO2 duy nhất(đktc) và 145,2 gam muối khan. Giá trị của là m gam:
A. 44 gam B. 46,4 gam. C. 58 gam D. 22 gam
Bài 13. Đốt cháy hoàn toàn 6,48 gam hỗn hợp X gồm: FeS , FeS2, S, Cu, CuS, FeCu2S2 thì cần 2,52 lít ôxi và thấy thoát ra 1,568 lít(đktc) SO2, mặt khác cho 6,48 gam X tác dụng dung dịch HNO3 nóng dư thu được V lít khí màu nâu duy nhất (đktc, sản phẩm khư duy nhất ) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa trắng.
Giá trị của V và m lần lượt là:
A. 13,44 lít và 23,44 gam. B. 8,96 lít và 15,60 gam.
C. 16,80 lít và 18,64 gam. D. 13,216 lít và 23,44 gam.
Đáp án
1B 2B 3A 4B 5A 6A
7B 8B 9A 10C 11A
12B 13D







