1. Các định nghĩa
- Anđehit là HCHC mà phân tử có nhóm - CHO liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
- Xeton là HCHC mà phân tử có nhóm chức -C(=O)- liên kết trực tiếp với 2 nguyên tử C.
- Axit cac boxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
2. Tính chất
a) Andehit có tính khử và tính oxi hóa
Tính oxi hóa : RCHO + H2 \[\xrightarrow{{{t}^{0}},Ni~}\] RCH2OH
Tính khử: RCHO + 2AgNO3 + 3NH3 + H2O \[\xrightarrow{{{t}^{0}}~}\] RCOONH4 + NH4NO3 + 2Ag↓
b) Xeton có tính oxi hóa
R-CO-R’ + H2 \[\xrightarrow{{{t}^{0}},Ni~}\] R-CHOH-R’
c) Axit cacboxylic có tính chất chung của axit
- Trong dung dịch phân li:
RCOOH ⥩ RCOO- + H+
- Tác dụng với bazo, oxit bazo, dung dịch muối và kim loại đứng trước H trong dãy hoạt động của kim loại.
- Tác dụng vơi ancol tạo thành este:
RCOOH + R’OH \[\]RCOOR’ + H2O
2. Điều chế
a) Điều chế andehit, xeton
- Oxi hóa ancol bậc 1 thu được andehit:
RCH2OH + CuO \[\xrightarrow{{{t}^{0}}~}\] RCHO + Cu + H2O
- Oxi hóa etilen đển sản xuất andehit axetic:
2CH2=CH2 + O2 \[\xrightarrow{{{t}^{0}},xt~}\] 2CH3CHO
- Oxi hóa ancol bậc 2 thu được xeton:
R-CH(OH)-R’ + CuO \[\xrightarrow{{{t}^{0}}~}\] R-CO-R’ + Cu + H2O
b) Điều chế axit cacboxylic
- Oxi hóa không hoàn toàn andehit:
2RCHO + O2 \[\xrightarrow{{{t}^{0}},xt~}\] 2RCOOH
- Oxi hóa cắt mạch ankan:
R-CH2-CH2-R1 + O2 \[\xrightarrow{{{t}^{0}},xt~}\]R-COOH + R1-COOH +2H2O
- Lên men ancol etylic bằng men giấm để điều chế axit axetic:
C2H5OH + O2→ CH3COOH + H2O(xt: men giấm)
- Sản xuất từ metanol:
CH3OH + CO \[\xrightarrow{{{t}^{0}},xt~}\] CH3COOH
Bài 1 (Trang 212 – SGK)
Điền Đ (đúng) hoặc S ( sai) vào ô vuông bên cạnh các câu sau :
a) Anđehit vừa có tính khử vừa có tính oxi hóa.
b) Anđehit là hợp chất lưỡng tính.
c) Khi tác dụng với hiđro có xúc tác Ni, anđehit chuyển thành ancol bậc I.
d) Axit axetic tác dụng được với dung dịch bazơ, oxit bazơ, muối cacbonat và kim loại đứng trước hiđro trong dãy hoạt động hóa học của kim loại.
e) Oxi hóa không hoàn toàn ancol bậc II thu được xeton.
f) Trong công nghiệp, axeton được tổng hợp từ cumen.
Lời giải:
a) Đ
b) S
c) Đ
d) Đ
e) Đ
f) Đ
Bài 2 (Trang 212 – SGK)
Trình bày phương pháp hóa học để phân biệt các dung dịch: anđehit axetic, axit axetic, glixerol, ancol etylic.
Lời giải:
.png)
Bài 3 (Trang 212 – SGK)
Dẫn hỗn hợp khí X gồm axetilen và anđehit axetic vào dung dịch AgNO3 trong ammoniac thấy tạo ra kết tủa gồm hai chất. Lấy kết tủa cho vào dung dịch axit HCl dư thấy có khí bay lên và còn một phần không tan Y. Hòa tan Y trong dung dịch HNO3 đặc thấy có khí màu nâu bay lên. Viết phương trình hóa học của các phản ứng xảy ra để giải thích quá trình thí nghiệm trên.
Lời giải:
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3
Lọc kết tủa: AgC≡CAg và Ag cho vào HCl chỉ có AgC≡CAg phản ứng:
AgC≡CAg + 2HCl → HC≡CH↑ + 2AgCl↓
Phần không tan Y là Ag và AgCl, hòa tan trong HNO3 đặc chỉ có Ag phản ứng:
Ag + 2HNO3 → AgNO3 + NO2nâu↑ + H2O
Bài 4 (Trang 213 – SGK)
Cho 1 gam axit axetic vào ống nghiệm thứ nhất và 1 gam axit fomic vào ống nghiệm thứ hai, sau đó cho vào cả hai ống nghiệm trên một lượng dư bột CaCO3. Đến khi phản ứng xảy ra hoàn toàn thì thể tích khí CO2 thu được (đo ở cùng điều kiện) thoát ra:
A. Từ hai ống nghiệm là bằng nhau.
B. Từ ống nghiệm thứ nhất nhiều hơn ống nghiệm thứ hai.
C. Từ ống nghiệm thứ hai nhiều hơn ống nghiệm thứ nhất.
D. Từ mỗi ống nghiệm đều lớn hơn 2,24 lít (đktc).
Lời giải:
- Đáp án C
.png)
Có nCH3COOH = 1/60 mol.
Theo pt (1) ⇒ nCO2(1) = 1/2. nCH3COOH = 1/2. 1/60 mol
nHCOOH = 1/46 mol.
Theo pt (2) ⇒ nCO2(2) = 1/2. nHCOOH = 1/2. 1/46 mol
⇒ số mol CO2 thoát ra từ ống nghiệm hai nhiều hơn ống nghiệm thứ nhất.
Bài 5 (Trang 213 – SGK)
Hỗn hợp A có khối lượng 10,0 gam gồm axit axetic và anđehit axetic. Cho A tác dụng với lượng dư AgNO3 trong dung dịch ammoniac thấy có 21,6 gam Ag kết tủa. Để trung hòa A cần V ml dung dịch NaOH 0,2M
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính thành phần phần trăm khối lượng của mỗi chất trong A và tính thể tích dung tích NaOH đã dùng.
Lời giải:
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
Theo (1):
.png)
Bài 6 (Trang 213 – SGK)
Viết phương trình hóa học của các phản ứng hoàn thành dãy chuyển hóa sau:
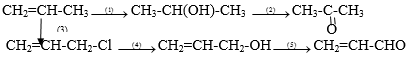
Lời giải:
.png)
Bài 7 (Trang 213 – SGk)
Hợp chất X có công thức phân tử C3H6O tác dụng với một lượng dư AgNO3 trong dung dịch NH3. Công thức nào sau đây là công thức cấu tạo của X?
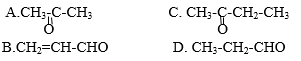
Lời giải:
Đáp án D.
- Vì X tác dụng với AgNO3 trong NH3 nên X phải là anđehit.
Bài 8 (Trang 213 – SGK)
Cho dung dịch chứa 0,58 gam chất hữu cơ X tác dụng với một lượng dư AgNO3 trong dung dịch NH3 thu được 2,15 gam kết tủa. Xác định công thức phân tử, viết công thức cấu tạo và gọi tên của hợp chất X?
Lời giải:
Hợp chất X đơn chức tác dụng được với AgNO3/NH3 thu được bạc kết tủa nên X là anđehit đơn chức.
Gọi công thức phân tử của X là R-CHO
RCHO + 2AgNO3 + 3NH3 + H2O → RCOONH4 + 2Ag↓ + 2NH4NO3
Theo phương trình:
\[{{n}_{RCHO}}=\frac{1}{2}Ag=\frac{1}{2}.\frac{2,16}{108}=0,01\,(mol)\]
\[\Rightarrow {{M}_{RCHO}}=\frac{0,58}{0,01}=58\Rightarrow R=59-29=29\]
\[\Rightarrow R:\,{{C}_{2}}{{H}_{5}}\Rightarrow X:\,{{C}_{2}}{{H}_{5}}CHO\]
CTCT của X là: CH3-CH2-CHO (propanal)
Bài 9 (Trang 213 – SGK)
Axit fomic tác dụng với AgNO3 trong dung dịch NH3 tạo ra kết tủa bạc kim loại. Dựa vào cấu tạo phân tử của axit fomic để giải thích, viết phương trình hóa học của phản ứng.
Lời giải:
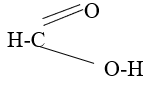
Do trong phân tử HCOOH có nhóm –CHO nên HCOOH phản ứng với AgNO3/NH3 như là một anđehit.
HCOOH + 2AgNO3 + 4NH3 + H2O → (NH4)2CO3 + 2Ag + 2NH4NO3
Bài 10 (Trang 213 – SGK)
Dẫn hơi của 3 gam etanol vào trong ống sứ nung nóng chứa bột CuO dư. Làm lạnh để ngưng tụ sản phẩm hơi đi ra khỏi ống sứ được chất lỏng A. Khi A phản ứng hoàn toàn với một lượng dư dung dịch AgNO3 trong NH3 thấy có 8,1 gam bạc kết tủa.
Tính hiệu suất của quá trình oxi hóa etanol?
Lời giải:
Phương trình phản ứng:
CH3CH2OH + CuO → CH3CHO + Cu+ H2O (1)
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag + 2NH4NO3 (2)
Theo (2): \[{{n}_{C{{H}_{3}}CHO}}=\frac{1}{2}Ag=\frac{1}{2}.\frac{8,1}{108}=0,0375\,(mol)\]
Theo (1): \[{{n}_{{{C}_{2}}{{H}_{5}}OH}}={{n}_{C{{H}_{3}}CHO}}=0,0375\,(mol)\]
\[\Rightarrow H=\frac{0,0375\,}{3}.100{\scriptstyle{}^{0}/{}_{0}}=57,5{\scriptstyle{}^{0}/{}_{0}}\]







