1. Định nghĩa, phân loại , danh pháp
a.Định nghĩa: Axit cacboxylic là những hợp chất hữu cơ mà phân tử của nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
Thí dụ: H-COOH, C2H5COOH, HOOC-COOH
Nhóm cacboxyl (-COOH) là nhóm chức của axit cacboxylic.
b.Phân loại
- Axit no, đơn chức mạch hở:
CnH2n+1COOH (n ≥ 0) hay CmH2mO2 (m ≥ 1)
VD: H-COOH, C2H5COOH...
- Axit không no, đơn chức, mạch hở:
VD: CH2=CH-COOH,....
- Axit thơm, đơn chức:
VD: C6H5-COOH, CH3-C6H4-COOH,...
- Axit đa chức:
VD: HOOC-COOH, HOOC-CH2-COOH...
c.Danh pháp
- Tên thay thế:
Tên gọi = axit + tên hiđrocacbon no tương ứng với mạch chính + “oic”
.png)
- Tên thông thường: Xuất phát từ nguồn gốc tìm ra chúng
VD: HOOC-COOH: axit oxalic HOOC-CH2-COOH: axit malonic
HOOC-[CH2]4-COOH: axit ađipic
2. Đặc điểm cấu tạo
-Nhóm cacboxyl (-COOH) là sự kết hợp bởi nhóm cacbonyl (>C=O) và nhóm hiđroxyl (-OH).
-Nhóm –OH và nhóm > C=O lại có ảnh hưởng qua lại lẫn nhau:
- Liên kết giữa H và O trong nhóm –OH phân cực mạnh, nguyên tử H linh động hơn trong ancol, anđehit và xeton có cùng số nguyên tử C.
3. Tính chất vật lý
-Ở ĐK thường các axit cacboxylic đều là những chất lỏng hoặc rắn.
-Nhiệt độ sôi tăng theo chiều tăng M và cao hơn các ancol có cùng M: nguyên nhân là do giữa các phân tử axit cacboxylic có liên kết hiđro bền hơn liên kết hidro giữa các phân tử ancol.
4.Tính chất hóa học
a.Tính axit
- Trong dung dịch, axit cacboxylic phân li thuận nghịch: CH3COOH ⇔ H+ + CH3COO-
Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ
- Tác dụng với bazơ, oxit bazơ tạo thành muối và nước:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
- Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
- Tác dụng với kim loại trước hiđro: 2CH3COOH + Zn → (CH3COO)2Zn + H2
b. Phản ứng thế nhóm –OH: Phản ứng giữa axit và ancol được gọi là phản ứng este hóa.
RCOOH + R’OH ⇔ RCOOR’ + H2O
Phản ứng thuận nghịch, xúc tác H2SO4 đặc.
5. Điều chế
a.Phương pháp lên men giấm: C2H5OH + O2 → CH3COOH + H2O
b.Oxi hóa anđehit axetic: 2CH3CHO + O2 → 2CH3COOH
c.Oxi hóa ankan: 2R-CH2-CH2-R’ + 5O2 → 2RCOOH + 2R’COOH + 2H2O
VD: CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O
d.Từ metanol: CH3OH + CO → CH3COOH
Bài 1 (Trang 210 – SGK)
Thế nào là axit cacbonxylic? Viết công thức cấu tạo, gọi tên các axit có công thức phân tử C4H8O2.
Lời giải
- Định nghĩa axit cacboxylic : là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon(1) hoặc nguyên tử hiđro.
((1): Nguyên tử cacbon này có thẻ của gốc hiđrocacbon hoặc của nhóm -COOH khác.)
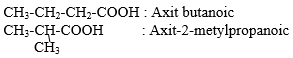
Bài 2 (Trang 210 – SGK)
Từ công thức cấu tạo, hãy giải thích tại sao axit fomic có tính chất của một anđehit.
Lời giải
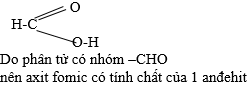
Bài 3 (Trang 210 – SGK)
Từ metan và các chất vô cơ cần thiết khác có thể điều chế được axit fomic, axit axetic. Viết phương trình hóa học của các phản ứng xảy ra
Lời giải
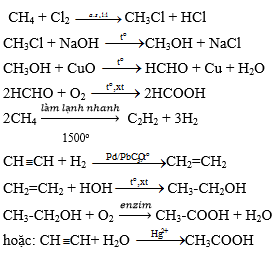
Bài 4 (Trang 210 – SGK)
Chất Y có công thức phân tử C4H8O2 tác dụng với NaOH tạo thành chất Z (C4H7O2Na). Vậy Y thuộc loại hợp chất nào sau đây?
A. Anđehit ; B. Axit.
C. Ancol ; D. Xeton.
Lời giải:
- Đáp án B.
- Phương trình minh họa:
CH3CH2CH2COOH + NaOH → CH3CH2CH2COONa + H2O
Bài 5 (Trang 210 – SGK)
Để trung hòa 150,0 gam dung dịch 7,40% của axit no, mạch hở, đơn chức X cần dùng 100,0 ml dung dịch NaOH 1,50M. Viết công thức cấu tạo và gọi tên của chất X.
Lời giải:
Gọi công thức phân tử của X là CnH2n+1COOH (n ≥ 1)
\[{{m}_{X}}=\frac{{\scriptstyle{}^{0}/{}_{0}}C.{{m}_{\text{dd}}}}{100{\scriptstyle{}^{0}/{}_{0}}}=\frac{7,4.150}{100}=11,1\,(g)\]
nNaOH = 0,1. 1,5 = 0,15(mol)
Phương trình phản ứng:
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
Theo phương trình: nCnH2n+1COOH = nNaOH = 0,15 (mol)
⇒ MX = 11,1/0,15 = 74
⇒ 14n + 46 = 74
⇒ n=2 ⇒ X: C2H5COOH (axit propanoic)
Bài 6 (Trang 210 – SGK)
Trung hòa 16,60gam hỗn hợp gồm axit axetic và axit fomic bằng dung dịch natri hiđroxit thu được 23,20 gam hỗn hợp hai muối.
a. Viết phương trình hóa học của các phản ứng ở dạng phân tử và ion rút gọn.
b. Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Lời giải:
a) Gọi số mol của axit axetic và axit fomic lần lượt là x và y (mol)
Phương trình hoá học ở dạng phân tử:
.png)
Phương trình hoá học ở dạng ion:
CH3COOH + OH- → CH3COO- + H2O
HCOOH + OH- → HCOO- + H2O
b) Theo đề bài ta có hệ phương trình:
.png)
Bài 7 (Trang 210 – SGK)
Đun 12,0 gam axit axetic với một lượng dư ancol etylic ( có axit H2SO4 đặc làm xúc tác ). Đến khi dừng thí nghiệm thu được 12,3 gam este.
a. Viết phương trình hóa học của phản ứng.
b. Tính phần trăm khối lượng của axit đã tham gia phản ứng este hóa.
Lời giải:
a) Phương trình hóa học:
CH3COOH + C2H5OH ---H2SO4→ CH3COOC2H5 + H2O
b)\[{{m}_{X}}=\frac{{\scriptstyle{}^{0}/{}_{0}}C.{{m}_{\text{dd}}}}{100{\scriptstyle{}^{0}/{}_{0}}}=\frac{7,4.150}{100}=11,1\,(g)\]
\[{{n}_{C{{H}_{3}}COOH}}=\frac{12}{60}=0,2\,(mol)\]
Ta thấy \[0,2>0,14\] mà theo phương trình ta có: \[{{n}_{C{{H}_{3}}COOH}}={{n}_{C{{H}_{3}}COOH{{C}_{2}}{{H}_{5}}}}\]
Từ đó suy ra CH3COOHdư.
\[\Rightarrow {{n}_{C{{H}_{3}}COOH}}={{n}_{C{{H}_{3}}COOH{{C}_{2}}{{H}_{5}}}}=0,14\,(mol)\]
\[\Rightarrow \] phần trăm axit bị este hóa là \[\frac{0,14.100{\scriptstyle{}^{0}/{}_{0}}}{0,2}=70{\scriptstyle{}^{0}/{}_{0}}\]







