I. Hệ thống hóa về hidrocacbon
.png)
II. Sự chuyển hóa giữa các loại hidrocacbon
.png)
Bài 1 (Trang 172 – Sgk)
So sánh tính chất hoá học của:
a. Anken với ankin
b. Ankan với ankylbenzen
Cho ví dụ minh hoạ
Lời giải
∗ So sánh tính chất hóa học anken và ankin:
- Giống nhau :
+ Cộng hiđro.
\[C{{H}_{2}}=C{{H}_{2}}+{{H}_{2}}\to C{{H}_{3}}-C{{H}_{3}}\]
\[CH\equiv CH+2{{H}_{2}}\to C{{H}_{3}}-C{{H}_{3}}\]
+ Cộng brom (dung dịch).
\[C{{H}_{2}}=C{{H}_{2}}+B{{r}_{2}}\to C{{H}_{2}}Br-C{{H}_{2}}Br\]
\[CH\equiv CH+2B{{r}_{2}}\to CHBr-CHBr\]
+ Cộng HX theo quy tắc Mac-côp-nhi-côp.
+ Làm mất màu dung dịch KMnO4.
.png)
- Khác nhau :
+ Anken : Không có phản ứng thế bằng ion kim loại.
+ Ankin : Ank-1-in có phản ứng thế bằng ion kim loại.
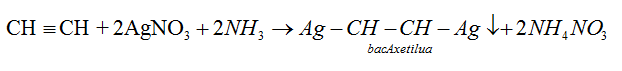
∗ So sánh tính chất hóa học ankan và ankybenzen:
- Giống nhau:
+ Phản ứng thế (halogen):
CH4 + Cl2 → CH3Cl + HCl
.png)
+ Phản ứng oxi hóa:
CH4 + 2O2 → CO2 +2H2O
C7H8 + 8O2 → 7CO2 + 4H2O
- Khác nhau:
+ Ankan: có phản ứng tách
C2H6 -500oC, xt→ CH2 = CH2 + H2
+ Ankylbenzen: có phản ứng cộng
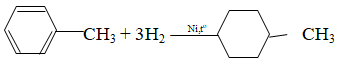
Bài 2 (Trang 172 – SGk)
Trình bày phương pháp hoá học
a. Phân biệt các bình đựng khí riêng biệt không dán nhãn: H2, O2, CH4, C2H4, C2H2
b. Tách riêng khí metan từ hỗn hợp với lượng nhỏ các chất C2H4, C2H2.
Lời giải
a. Lấy các mẫu khí nhỏ từ các bình đừng khí và đánh số theo thứ tự.
- Cho tàn đóm qua các mẫu khí, mẫu nào làm tàn đóm bùng cháy thì đó là O2.
- Lần lượt dẫn các mẫu khí còn lại qua dung dịch AgNO3/NH3, mẫu khí nào làm dung dịch xuất hiện kết tủa vàng thì đó là C2H2.
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
- Lần lượt dẫn các mẫu khí còn lại qua dung dịch brôm, khí nào làm nhạt màu dung dịch brôm thì đó là C2H4.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
- Đốt cháy hai mẫu khí còn lại, dẫn sản phẩm qua bình đựng dung dịch Ca(OH)2 dư, nếu xuất hiện kết tủa trắng thì đó là CH4
2H2 + O2 → 2H2O
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
- Khí còn lại là H2
b. Cho hỗn hợp khí đi qua dung dịch Br2 dư, C2H4 và C2H2 sẽ tác dụng hết với dung dịch Br2, khí đi ra là metan.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
CH≡CH + 2Br2 (nâu đỏ) → Br2CH-CHBr2 (không màu)
Bài 3 (Trang 172 – SGK)
Viết các phương trình hoá học của các phản ứng hoàn thành dãy chuyển hoá sau:

Lời giải
.png)
.png)
.png)
Bài 4 (Trang 172 – SGK)
Viết phương trình hoá học tổng quát của phản ứng đốt cháy các loại hiđrocacbon đã nêu trong bảng 7.2. Nhận xét về tỉ lệ số mol CO2 và số mol H2O trong sản phẩm cháy của mỗi loại hiđrocacbon.
Lời giải
.png)
Bài 5 (Trang 172 – SGK)
Khi đốt cháy hoàn toàn hiđrocacbon X (là chất lỏng ở điều kiện thường) thu được CO2 và H2O có số mol theo tỉ lệ 2:1. Công thức phân tử của X có thể là công thức nào sau đây?
A. C4H4 ; B. C5H12
C. C6H6 ; D. C2H2
Lời giải
- Đáp án C
- Khi đốt cháy X thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1
=> X có số C bằng số H
Mà X là chất lỏng ở điều kiện thường nên X chỉ có thể là C6H6







