I.Tính chất của đơn chất
.png)
II.Tính chất của hợp chất của N và P
1.Hợp chất của nitơ
- Amoniac
- Tan rất nhiều trong nước do nó là phân tử phân cực mạnh.
- Tạo thành dung dịch có tính bazơ yếu ngoài ra amoniac còn có tính khử.
- Muối amoni tan nhiều trong nước, điện li mạnh và dễ bị nhiệt phân.
- Axit nitric (HNO3)
- Là axit mạnh
- Là chất oxi hóa mạnh. Tính oxi hóa mạnh do ion NO3- gây ra, nên sản phẩm là các hợp chất khác nhau của nitơ
- Muối nitrat
- Dễ tan
- Trong dung dịch axit , NO3- thể hiện tính oxi hóa.
- Muối rắn dễ bị nhiệt phân cho oxi thoát ra.
- Phản ứng nhận biết:
3Cu + NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
(dd màu xanh)
2NO + O2 → 2NO2 (màu nâu đỏ)
2.Hợp chất của photpho
- Axit photphoric (H3PO4)
- Là axit ba nấc, độ mạnh trung bình, tác dụng với dung dịch kiềm cho ba loại muối: một muối photphat trung hòa và hai muối photphat axit.
- Không thể hiện tính oxi hóa
- Muối photphat
- Muối photphat trung hòa và photphat axit của natri, kali, amoni dễ tan.
- Muối đihiđrophotphat của các kim loại dễ tan.
- Phản ứng nhận biết:
3Ag+ + PO43- → Ag3PO4↓
(màu vàng)
Bài 1 (Trang 61 – SGK)
Hãy cho biết số oxi hóa của N và P trong các phân tử và ion sau đây NH3, NH4+, NO2-, NO3-, NH4HCO3 , P2O3, PBr5, PO43–, KH2PO4, Zn3(PO4)2.
Bài giải
\[\overset{-3}{\mathop{N}}\,{{H}_{3}};\,\overset{-3}{\mathop{N}}\,H_{4}^{+};\,\overset{+3}{\mathop{N}}\,O_{2}^{-};\,\overset{+5}{\mathop{N}}\,O_{3}^{-};\,\overset{-3}{\mathop{N}}\,{{H}_{4}}HC{{O}_{3}};\,\overset{+3}{\mathop{{{P}_{2}}}}\,{{O}_{3}};\,\overset{+5}{\mathop{P}}\,B{{r}_{5}};\,\overset{+5}{\mathop{P}}\,O_{4}^{3-};\,K{{H}_{2}}\overset{+5}{\mathop{P}}\,{{O}_{4}};\,\,Z{{n}_{3}}{{\left( \overset{+5}{\mathop{P}}\,{{O}_{4}} \right)}_{2}}\]
Bài 2 (Trang 61 – sGK)
Trong các công thức sau đây, chọn công thức hóa học đúng của magie photphua:
A. Mg3(PO4)2
B. Mg(PO3)2
C. Mg3P2
D. Mg2P2O7
Bài giải
Chọn C.
Bài 3 (Trang 61 – SGK)
a) Lập các phương trình hóa học sau đây:
NH3 + Cl2 (dư) → N2 + ..
NH3(dư) + Cl2 → NH4Cl + ….
NH3 + CH3COOH → …
(NH4)3PO4 -to→ H3PO4 + …
Zn(NO3)2 -to→ …
b) Lập các phương trình hóa học ở dạng phân tử và dạng ion rút gọn của phản ứng giữa các chất sau đây trong dung dịch:
(1) K3PO4 và Ba(NO3)2
(2) Na3PO4 và CaCl2
(3) Ca(H2PO4)2 và Ca(OH)2 với tỉ lệ mol 1:1
(4) (NH4)3PO4 + Ba(OH)2
Bài giải
.png)
.png)
Bài 4 (Trang 61 – SGK)
Từ hiđro, clo, nitơ và các hóa chất cần thiết, hãy viết các phương trình hóa học (có ghi rõ điều kiện phản ứng) điều chế phân đạm amoni clorua.
Bài giải
\[{{H}_{2}}+C{{l}_{2}}\xrightarrow{{{t}^{0}}}2HCl\]
\[{{N}_{2}}+3{{H}_{2}}\overset{xt,{{t}^{0}},p}{leftrightarrows}2N{{H}_{3}}\]
\[HCl+N{{H}_{3}}\to N{{H}_{4}}Cl\]
Bài 5 (Trang 61 – SGK)
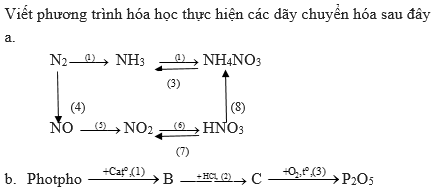
Bài giải
.png)
Bài 6 (Trang 62- SGK)
Hãy đưa ra những phản ứng đã học có sự tham gia của đơn chất photpho, trong đó số oxi hóa của photpho:
a. Tăng
b. Giảm
Bài giải
a) \[4\overset{0}{\mathop{P}}\,+5\overset{0}{\mathop{{{O}_{2}}}}\,\xrightarrow{{{t}^{0}}}2\overset{+5}{\mathop{{{P}_{2}}}}\,\overset{-2}{\mathop{{{O}_{5}}}}\,\]
\[3\overset{0}{\mathop{P}}\,+5H\overset{+5}{\mathop{N{{O}_{3}}}}\,+2{{H}_{2}}O\to 3{{H}_{3}}P{{O}_{4}}+5NO\uparrow \]
\[2\overset{0}{\mathop{P}}\,+5C{{l}_{2}}\to 2\overset{+5}{\mathop{P}}\,C{{l}_{5}}\]
b) \[2\overset{0}{\mathop{P}}\,+3\overset{0}{\mathop{Mg}}\,\to {{\overset{+2}{\mathop{Mg}}\,}_{3}}\overset{-3}{\mathop{{{P}_{2}}}}\,\]
Bài 7 (Trang 62 – SGK)
Khi cho 3,00 g hỗn hợp Cu và Al tác dụng với dung dịch HNO3 đặc dư, đun nóng, sinh ra 4,48 lít khí duy nhất NO2 (đktc). Xác định phần trăm khối lượng của mỗi kim loại trong hỗn hợp?
Bài giải
Gọi nAl = x (mol), nCu = y (mol); nNO2 = 4,48/22,4 = 0,2 mol
Al + 6HNO3 (đặc) -to→ Al(NO3)3 + 3NO2↑ + 3H2O
x 3x (mol)
Cu + 4HNO3 (đặc) Cu(NO3)2 + 2NO2↑ + 2H2O
y 2y (mol)
Theo pt: nNO2(1) = 3. nAl = 3.x mol
nNO2(2) = 2. nCu = 2y mol
⇒ Tổng nNO2 = 3x + 2y = 0,2 mol
Ta có hệ phương trình
.png)
.png)
Bài 8 (Trang 62 – SGK)
Cho 6,00 g P2O5 vào 25,0 ml dung dịch H3PO4 6,00% (D = 1,03 g/ml). Tính nồng độ phần trăm H3PO4 trong dung dịch tạo thành?
Bài giải
mdd H3PO4 = V. D = 25. 1,03 = 25,75g
\[{{m}_{{{H}_{3}}P{{O}_{4}}}}\](ban đầu)\[=\frac{25,75.6}{100}=1,545\,(g)\]
.png)
Theo pt nH3PO4 = 2. nP2O5 = (2.6) / 142 = 6/71 (mol)
⇒ mH3PO4 = (6.98)/71 = 8,282 g
mH3PO4(sau phản ứng) = 1,545 + 8,282 = 9,827(g)
Khối lượng dung dịch sau phản ứng = 25,75 + 6 = 31,75(g)
\[C{{{\scriptstyle{}^{0}/{}_{0}}}_{{{H}_{3}}P{{O}_{4}}}}=\frac{9,827}{31,75}.100{\scriptstyle{}^{0}/{}_{0}}=30,95{\scriptstyle{}^{0}/{}_{0}}\]
Bài 9 (Trang 62 – SGK)
Cần bón bao nhiêu kg phân đạm amoni nitrat chứa 97,5% NH4NO3 cho 10,0 hecta khoai tây, biết rằng 1,00 hecta khoai tây cần 60,0 kg nitơ?
Bài giải
10ha khoai tây cần 60. 10 = 600 kg nitơ
Bảo toàn nguyên tố Nito:
⇒ 1 mol (80g) NH4NO3 tạo thành 1 mol (28g)N2
Lượng NH4NO3 cần để có 600kg N2 là
\[\frac{600.80}{28}=1714,286\,(kg)\]
Phân đạm amoni nitrat chứa 97,5% NH4NO3 nên lượng phân đạm cần bón là:
\[\frac{1714,286}{97,5}.100=1758,24\,(kg)\]







