I. TÓM TẮT LÍ THUYẾT
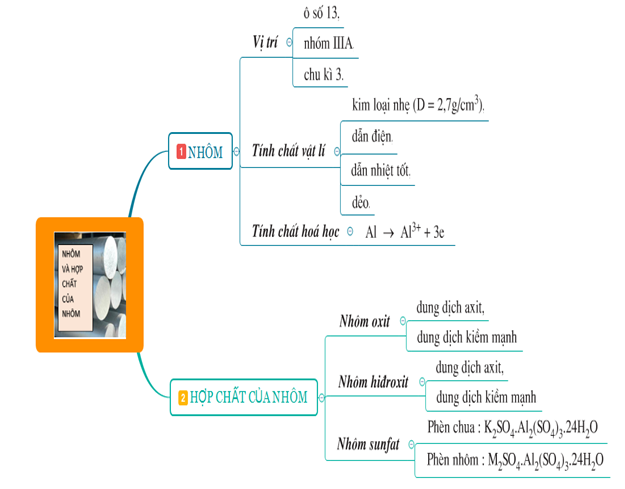
II. GIẢI BÀI TẬP SÁCH GIÁO KHOA
Câu 1. (Trang 134 SGK)
Nhôm bền trong môi trường không khí và nước là do
A. nhôm là kim loại kém hoạt động.
B. có màng oxit Al2O3 bền vững bảo vệ.
C. có màng hiđroxit Al(OH)3 bền vững bảo vệ.
D. nhôm có tính thụ động với không khí và nước.
Bài làm:
Đáp án B
Nhôm bền trong môi trường không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ.
Câu 2. (Trang 134 SGK)
Nhôm không tan trong dung dịch nào sau đây?
A. HCl;
B. H2SO4;
C. NaHSO4;
D. NH3.
Bài làm:
Đáp án D
Nhôm không tan trong dung dịch NH3.
Câu 3. (Trang 134 SGK)
Cho 31,2 gam hỗn hợp bột Al và Al2O3 tác dụng hết với dung dịch NaOH dư thu được 13,44 lít H2 ở đktc. Khối lượng từng chất trong hỗn hợp ban đầu lần lượt là
A.16,2 gam và 15 gam.
B. 10,8 gam và 20,4 gam.
C. 6,4 gam và 24,8 gam.
D. 11,2 gam và 20 gam.
Bài làm:
Ta có nH2 = \[\frac{13,44}{22,4}\]= 0,6 (mol).
Khi cho hỗn hợp bột Al và Al2O3 tác dụng hết với dung dịch NaOH dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Từ 2 phương trình phản ứng: =>nAl = \[\frac{0,6.2}{3}\] = 0,4 (mol)
=>mAl = 27.0,4 = 10,8 (gam); mAl2O3 = 31,2 -10,8 = 20,4 (gam).
Câu 4. (Trang 134 SGK)
Chỉ dùng thêm 1 hóa chất, hãy phân biệt các chất trong những dãy sau và viết phương trình hóa học để giải thích.
a) Các kim loại: Al, Ca, Na.
b) Các dung dịch: NaCl, CaCl2, AlCl3.
c) Các chất bột: CaO, MgO, Al2O3.
Bài làm:
a) Lấy từng kim loại cho tác dụng với nước.
Na tác dụng với nước mãnh liệt tạo thành dung dịch trong suốt.
2Na + 2H2O → 2NaOH + H2
Ca tan trong nước tạo dung dịch vẩn đục do Ca(OH)2 ít tan ;
Ca + H2O → Ca(OH)2 + H2
Mg, Al không tan.
Cho dung dịch NaOH vừa thu được vào Mg, Al, kim loại tan là Al, còn lại là Mg.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
b) Cho dung dịch NaOH tác dụng lần lượt với tùng muối.
Dung dịch nào thấy tạo kết tủa vẩn đục là dung dịch CaCl2;
2NaOH + CaCl2 → Ca(OH)2 + 2NaCl
Dung dịch tạo kết tủa trắng keo sau đó tan khi cho dư NaOH là dung dịch AlCl3, còn lại là dung dịch NaCl.
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
c) Hòa tan lần lượt các loại bột vào trong nước.
Chất nào tan trong nước tạo dung dịch vẩn đục là CaO. CaO + H2O → Ca(OH)2
Lọc bỏ kết tủa và cho dung dịch Ca(OH)2 vào 2 chất còn lại, chất nào tan là Al2O3; không tan là MgO.
Al2O3 + 2OH- → 2AlO2- + H2O
Câu 5. (Trang 134 SGK)
Viết phương trình hóa học để giải thích các hiện tượng xảy ra khi
a) cho dung dịch NH3 dư vào dung dịch AlCl3.
b) cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3.
c) cho từ từ dung dịch Al2(SO4)3 vào dung dịch NaOH và ngược lại.
d) sục từ từ đến dư khi CO2 vào dung dịch NaAlO2.
e) cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
Bài làm:
a) Cho dung dịch NH3 dư vào dung dịch AlCl3.
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
b) Cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH (dư) → NaAlO2 + 2H2O
c) Cho từ từ dung dịch Al2(SO4)3 vào dung dịch NaOH
Al2(SO4)3 + 8NaOH → 2NaAlO2 + 3Na2SO4 + 4H2O
Al2(SO4)3 + 6NaOH → Al(OH)3↓ + 3Na2SO4
Cho từ từ dung dịch NaOH vào dung dịch Al2(SO4)3
Al2(SO4)3 + 6NaOH → Al(OH)3↓ + 3Na2SO4
Al(OH)3↓ + NaOH (dư) → NaAlO2 + 2H2O.
d) Sục từ từ đến dư khi CO2 vào dung dịch NaAlO2.
CO2 + 2H2O + NaAlO2 → Al(OH)3↓ + NaHCO3
e) Cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
HCl + NaAlO2 + H2O → Al(OH)3 + NaCl
Al(OH)3 + 3HCl (dư) → AlCl3 + 3H2O.
Câu 6. (Trang 134 SGK)
Hỗn hợp khí X gồm hai kim loại K và Al có khối lượng 10,5 gam. Hòa tan hoàn toàn hỗn hợp X trong nước được dung dịch A. Thêm từ từ dung dịch HCl 1M vào dung dịch A: lúc đầu không có kết tủa, khi thêm được 100 ml dung dịch HCl 1M thì bắt đầu có kết tủa. Tính thành phần % số mol của các kim loại trong X.
Bài làm:
Gọi số mol K, Al trong hỗn hợp ban đầu lần lượt là x và y (mol)
=>mhh = 39x + 27y = 10,5 (g) (*)
Khi cho hỗn hợp vào nước:
2K + 2H2O → KOH + H2 (1)
(mol) x x
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
(mol) y y
Khi thêm HCl 1M vào dung dịch A chưa thấy kết tủa xuất hiện =>KOH dư vì HCl để trung hòa KOH
HCl + KOH → KCl + H2O (3)
nHCl = nKOH dư = 0,1 .1 = 0,1 mol = x – y (**)
Từ (*) và (**) => x = 0,2 ; y = 0,1
Phần trăm số mol trong hỗn hợp đầu là:
%K = (\[\frac{0,2}{0,3}\]) .100% = 66,67%;
%Al = 100% - 66,67% = 33,33%.







