I.TÓM TẮT
1. Cách pha chế dung dịch theo nồng độ cho trước
Đầu tiên ta xác định chất tan, dung môi là chất nào?
Có 2 kiểu pha chế:
- Pha chế dung dịch theo nồng độ phần trăm
- Pha chế dung dịch theo nồng độ mol
Bài tập 1: Từ muối CuSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 50 gam dung dịch CuSO4 10%.
a) Tính toán
Đề bài cho khối lượng chất tan là 50 gam dung dịch CuSO4 và nồng độ phần trăm của dung dịch C% = 10%.
Vận dụng công thức tính khối lượng chất tan ta có:
\(m_{CuSO_{4}} = \frac{{C\% .{m_{dd}}}}{{100\% }}\) = \(\frac{{10\%.50 }}{{100\% }} = 5(gam)\)
Các em lưu ý tới công thức tính khối lượng dung dịch là mdung dịch = mdung môi + mchất tan
Có khối lượng chất tan (5gam CuSO4), có khối lượng dung dịch (50 gam). Như vậy ta suy ra được khối lượng dung môi (nước)
mdung dịch = mdung môi + mchất tan ⇒ mdung môi = mdung dịch - mchất tan = 50 - 5 = 45 (gam)
Vậy khối lượng nước cần dùng cho sự pha chế là 45 gam.
b) Cách pha chế:
Bước 1: Chuẩn bị
- Dụng cụ: Cân phân tích (cân có tính chính xác cao, tính theo mg), cốc chia độ, đũa thủy tinh, ống đong
- Hóa chất: CuSO4 rắn, khan, nước cất.
Bước 2: Tiến hành pha chế
- Cân lấy 45 gam tinh thể CuSO4 (màu xanh)
- Dùng ống đong, đong 100ml nước cất rồi đổ vào cốc chia độ.
- Cho 5 gam CuSO4 vào cốc rồi khuấy đều bằng đũa thủy tinh ta được 50 gam dung dịch CuSO4 10%.
Bài tập 2: Từ muối CuSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 50 ml dung dịch CuSO4 1M.
a) Tính toán
Từ công thức tính nồng độ mol của dung dịch nhận thấy có chứa 3 ẩn là số mol (n), thể tích (V) và nồng độ mol (CM).
Đề bài cung cấp 2 dữ kiện là thể tích dung dịch và nồng độ mol (1mol/l)
Vì đơn vị của nồng độ mol là mol/lít nên dữ kiện ml phải đổi về lít: 50 ml = \(\frac{{50}}{{1000}} = 0,05(lit)\)
Cho nguyên tử khối của Cu = 64, S = 32, O = 16
Cụ thể như sau:
Số mol CuSO4 chứa trong 50 ml dung dịch CuSO4 1M là:
\(n = {C_M}.V = 1.0,05 = 0,05(mol)\)
Khối lượng CuSO4 chứa trong 50 ml dung dịch CuSO4 1M là:
\({m_{CuS{O_4}}} = {n_{CuS{O_4}}}.{M_{CuS{O_4}}} = 0,05.(64 + 32 + 16.4) = 8(gam)\)
Vậy khối lượng CuSO4 cần thêm vào là 8 gam để tạo 50 ml dung dịch CuSO4 1M.
b) Cách pha chế
Bước 1: Chuẩn bị
-
- Dụng cụ: Cân phân tích (cân có tính chính xác cao, tính theo mg), cốc chia độ, đũa thủy tinh, ống đong
- Hóa chất: CuSO4 rắn, khan, nước cất.
Bước 2: Tiến hành pha chế
-
- Cân 8g CuSO4 cho vào cốc thủy tinh dung tích 100ml.
- Đổ đần dần nước cất vào cốc và khuấy nhẹ cho đủ 50 ml dung dịch ta được 50 ml dung dịch CuSO4 1M.
2. Cách pha loãng dung dịch theo nồng độ cho trước
Bài tập 1: Từ muối MgSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 100ml dung dịch MgSO4 0,4 M từ dung dịch MgSO4 2M.
a) Tính toán
Từ công thức tính nồng độ mol của dung dịch nhận thấy có chứa 3 ẩn là số mol (n), thể tích (V) và nồng độ mol (CM).
Đề bài cung cấp 2 dữ kiện là thể tích dung dịch (100 ml) và nồng độ mol (0,4M)
Lưu ý: Vì đơn vị của nồng độ mol là (mol/lit) nên thể tích phải đổi từ ml sang lít.
Cho nguyên tử khối của Mg = 24, S = 32, O = 16
Cụ thể như sau:
Đổi 100ml thành 0,1 lít
Số mol chất tan có trong 100ml dung dịch 0,4M:
\({n_{MgS{O_4}}} = {C_M}.V = 0,4.0,1 = 0,04(mol)\)
+ Thể tích dung dịch MgSO4 2M trong đó có 0,04 mol MgSO4:
\(V' = \frac{n}{{{C_M}'}} = \frac{{0,04}}{2} = 0,02(lit)=20(ml)\)
b) Cách pha chế
Bước 1: Chuẩn bị
- Dụng cụ: Cốc chia độ, đũa thủy tinh, ống đong
- Hóa chất: dung dịch MgSO4 2M, nước cất
Bước 2: Tiến hành pha chế
- Lấy 20ml dung dịch MgSO4 cho vào cốc thủy tinh 250ml
- Đổ từ từ nước cất vào cốc và khuấy nhẹ đến 100ml thì dừng lại ta được 100ml dung dịch MgSO40,04M.
Bài tập 2: Từ muối NaCl, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế 150g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
a) Tính toán
Khối lượng NaCl trong 150g dung dịch NaCl 2,5% là:
\({m_{NaCl}} = \frac{{C\% .{m_{{\rm{dd}}}}}}{{{\rm{100\% }}}} = \frac{{2,5.150}}{{100}} = 3,75(g)\)
Khối lượng dung dịch NaCl ban đầu chứa 3,75g NaCl là:
\({m_{{\rm{dd}}}} = \frac{{{m_{ct}}.100\% }}{{C\% }} = \frac{{3,75.100}}{{10}} = 37,5(g)\)
Khối lượng nước cần dùng là:
mdm= 150 – 37,5 = 112,5(g)
b) Cách pha chế
Bước 1: Chuẩn bị
- Dụng cụ: Cân phân tích (cân có tính chính xác cao, tính theo mg), cốc chia độ hoặc bình tam giác, đũa thủy tinh, ống đong
- Hóa chất: muối NaCl, nước cất
Bước 2: Tiến hành pha chế
- Cân lấy 37,5g dung dịch NaCl 10% cho vào cốc thủy tinh 200ml (hoặc bình tam giác.
- Đong lấy 112,5ml nước cất rồi đổ từ từ vào cốc đựng dung dịch NaCl 10%, khuấy đều. Ta được dung dịch NaCl 2,5%.
Lưu ý: Khi cân dung dịch ta cân cả dung dịch và bình chứa dung dịch nên ta sẽ cân riêng bình đựng, sau đó lấy tổng khối lượng trừ đi khối lượng bình là ra được khối lượng dung dịch chứa trong bình. Cụ thể như bài này. Khối lượng bình rỗng là 50 gam, tổng khối lượng bình và dung dịch là 87,8 gam. Như vậy ta vừa cân được 87,5 - 50 = 37,5 gam dung dịch.
II.GIẢI BÀI TẬP SÁCH GIÁO KHOA
Câu 1 : Trang 149 sgk hóa 8
Làm bay hơi 60 g nước từ dung dịch có nồng độ 15% được dung dịch mới có nồng độ 18%. Hãy xác định khối lượng của dung dịch ban đầu.
Bài làm:
Gọi khối lượng dung dịch ban đầu là m (g)
=> khối lượng dung dịch sau khi làm bay hơi là: (m - 60) gam
Khối lượng chất tan không đổi
=> mct = \(\frac{15.m}{100}\) = \(\frac{18(m-60)}{100}\)
⇔ 15 . m = 18(m - 60)
⇔ 15m = 18m - 1080
⇔ 3m = 1080
⇔ m = 360 gam.
Câu 2 : Trang 149 sgk hóa 8
Đun nhẹ 20 g dung dịch CuSO4 cho đến khi nước bày hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6 g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4 .
Bài làm:
Từ đề bài => mct = 3,6 (g) và mdd = 20 (g)
Nồng độ phần trăm của dung dịch:
=>C% CuSO4 = \(\frac{m_{ct}}{m_{dd}}\) . 100% = \(\frac{3,6}{20}\) . 100% = 18%
Câu 3 : Trang 149 sgk hóa 8
Cân lấy 10,6 g Na2CO3 cho vào cốc chia độ có dung tích 500 ml. Rót từ từ nước cất vào cốc cho đến vạch 200 ml. Khuấy nhẹ cho Na2CO3 tan hết, ta được dung dịch Na2CO3. Biết 1 ml dung dịch này cho khối lượng là 1,05 g
Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được.
Bài làm:
Ta có: khối lượng của dung dịch Na2CO3 là: mNa2CO3 = 200 . 1,05 = 210 g
=> Nồng độ phần trăm của dung dịch: C% = \(\frac{10,6}{210}\) . 100% = 5,05%
Ta có: nNa2CO3 = \(\frac{10,6}{(46+12+48)}\) = 0,1 (mol)
=> Nồng độ mol của dung dịch: CM = \(\frac{0,1.1000}{200}\) = 0,5 M
Câu 4 : Trang 149 sgk hóa 8
Hãy điền những giá trị chưa biết bào những ô trống trong bảng bằng cách thực hiện các tính toán theo mỗi cột:
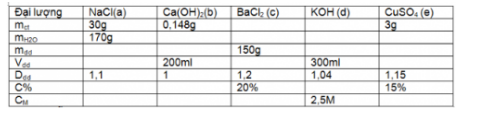
Bài làm:
Dung dịch NaCl:
mdd =200g; V= m/D = 200/1,1 ≈ 182ml ; C% : 15%; CM =2,8M.
Dung dịch Ca(OH)2 .
mH2O = 199,85g; mdd = 200g; C%=0,074% ; CM = 0,01M.
Dung dịch BaCl2.
Mct = 30g; mH2O = 120g; Vdd = 125ml; CM = 1,152M.
Dung dịch KOH.
Mct = 42g; mH2O = 270g; mdd = 312ml; C%= 13,46%.
Dung dịch CuSO4.
Mdd = 20g; mH2O = 17g; Vdd= 17,39ml; CM = 1,078M.
Câu 5 : Trang 149 sgk hóa 8
Tìm độ tan của một muối trong nước bằng phương pháp thực nghiệm người ta có được những kết quả sau:
- Nhiệt độ của dung dịch muỗi bão hòa là 200C
- Chén sứ nung có khối lượng 60,26 g
- Chén sứ đựng dung dịch muối có khối lượng 86,26 g
- Khối lượng chén nung và muối kết tinh sau khi làm bay hết hơi nước là 66,26 g
Hãy xác định độ tan của muối ở nhiệt độ 200C
Bài làm:
Ta có: mdd = 86,26 – 60,26 = 26 (gam)
mct = 66,26 – 60,26 = 6 (gam)
Ở 20℃, cứ 20 gam nước hòa tan 6 gam muối tạo dung dịch bão hòa. Vậy ở 20℃, 100 gam nước hòa tan khối lượng muối là:
\(S = {{100 . 6} \over {20}} = 30\left( {gam} \right)\)
Vậy độ tan của muối ở 20℃ là 30 gam







