A – TÓM TẮT KIẾN THỨC
I. Khái niệm, phân loại và danh pháp
1. Khái niệm
- Khái niệm: Khi ta thay thế 1 hay nhiều nguyên tử H trong phân tử NH3 bằng 1 hay nhiều gốc hidrocacbon ta được amin.
- Amin thường có đồng phân về mạch cacbon, về vị trí của nhóm chức và về bậc amin.
2. Phân loại
- Theo gốc hiđrocacbon
- Amin mạch hở : CH3NH2 , C2H5NH2 ,…
- Amin thơm: C6H5NH2 , CH3C6H4NH2,…
- Phân loại theo bậc
- Bậc 1: CH3NH2
- Bậc 2: C2H5NHCH3
- Bậc 3:
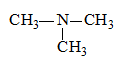
3. Danh pháp
- Gọi theo gốc – chức: Tên của amin = tên gốc hiđrocacbon + amin
VD: C2H5NH2: etylamin
- Gọi tên thay thế :Tên amin = tên ankan tương ứng + số chỉ vị trí + amin
VD: CH3CH2CH2NH2 : propan – 1 – amin.
Chú ý:
- Tên các nhóm ankyl đọc theo thứ tự chữ cái a, b, c…
- Với các amin bậc 2 và 3, chọn mạch dài nhất chứa N làm mạch chính, N có chỉ số vị trí nhỏ nhất. Đặt một nguyên tử N trước mỗi nhóm thế của amin
II. Tính chất vật lí
- Metylamin, đimetylamin, trimetylamin và etylamin là những chất khí, mùi khai khó chịu, tan nhiều trong nước.
- Các amin có phân tử khối cao hơn là những chất lỏng hoặc rắn, nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Các amin thơm dễ bị oxi hóa chuyển thành màu đen.
- Các amin đều độc
III – Cấu tạo phân tử và tính chất hóa học
1.Cấu tạo phân tử
- Trong phân tử amin, nguyên tử N tạo được 1, 2, 3 liên kết với gốc hiđrocacbon tạo thành amin bậc một, hai, ba.
- Các phân tử amin đều có nguyên tử Nito giống phân tử NH3 nên amin có tính bazơ, ngoài ra còn có tính chất của gốc hiđrocacbon.
2. Tính chất hóa học
a) Tính bazơ
- Các amin tan nhiều trong nước như CH3NH2, C2H5NH2,… làm xanh quỳ hoặc làm hồng phenolphatalein. Lực bazo mạnh hơn NH3 nhờ ảnh hưởng của nhóm ankyl
- Anilin có tính bazo yếu hơn NH3 do ảnh hưởng của gốc phenyl, vì vậy không làm đổi màu quỳ tím hay phenolphatalein
- So sánh lực bazơ:
- CH3NH2>NH3 >C6H5NH2
- Ankylamin>NH3>C6H5NH2
b)Tác dụng với dung dịch axit
CH3NH2+HCl→[CH3NH3]+Cl-
Metylamoni clorua
C6H5NH2+HCl→[C6H5NH3]+C
Phenylamoni clorua
c) Phản ứng thế nhân thơm của anilin
C6H5NH2+3Br2→C6H2Br3NH2↓+3HBr (2,4,6-tribromanilin)
(trắng)
Phản ứng này dùng để nhận biết anilin.
B – GIẢI BÀI TẬP SÁCH GIÁO KHOA
Bài 1:
Viết đồng phân amin bậc 1 có công thức C4H11N
Hướng dẫn:
Amin bậc 1 của C4H11N có 4 đồng phân:
\(C - C - C - C - N{H_2}\)
\(C - C - C\left( {N{H_2}} \right) - C\)
\(C - C\left( {C{H_3}} \right) - C - N{H_2}\)
\({\left( {C{H_3}} \right)_3} - C - N{H_2}\)
Bài 2:
Sắp xếp tăng dần tính bazơ của các chất ở dãy sau: NH3, C6H5NH2, CH3NHCH3, CH3CH2NH2.
Hướng dẫn:
- Dựa vào Gốc amin: Gốc đẩy e < NH3< Gốc hút e
C6H5NH2 < NH3 < CH3CH2NH2 ,CH3NHCH3
- Dựa vào bậc Amin: Bậc 3< Bậc 2 < Bậc 1< NH3
CH3CH2NH2 < CH3NHCH3
⇒ C6H5NH2 < NH3 < CH3CH2NH2 < CH3NHCH3
Bài 3:
Cho 9,3 gam anilin tác dụng với brom dư thì thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
C6H5NH2 + 3Br2 → C6H2NH2(Br)3↓ + 3HBr
⇒ mkết tủa = 33 g
Bài 4:
Amin X đơn chức. Cho 0,1 mol X phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được 8,15 gam muối. %mC trong X có giá trị là:
Hướng dẫn:
RNH2 + HCl → RNH3Cl
⇒ namin = nmuối = 0,1 mol
⇒ Mmuối = 81,5g ⇒ R = 29 (C2H5)
Amin là C2H5NH2
⇒ %mC(X) = 53,33%
C – BÀI TẬP AMIN NÂNG CAO
Bài 1:
Cho 20 gam hỗn hợp gồm 3 amin no, đơn chức, là đồng đẳng liên tiếp của nhau tác dụng vừa đủ với dung dịch HCl, cô cạn dung dịch thu được 31,68 gam hỗn hợp muối. Nếu 3 amin trên trộn theo tỷ lệ số mol 1 : 10 : 5 và thứ tự phân tử khối tăng dần thì công thức phân tử của 3 amin là
Hướng dẫn:
\(C_{\bar{n}}H_{2\bar{n}+3}N+HCl\rightarrow C_{\bar{n}}H_{2\bar{n}+3}NHCl\)
a → a → a
\(a=\frac{31,68-20}{36,5}=0,32(mol)\)
\(\bar{M}=\frac{20}{0,32}=14\bar{n}+17\)
\(\bar{n}=3,25\)
Gọi n C có amin (I) 1mol
(n+1) (II) 10mol
(n+2) (III) 5mol
\(\bar{n}=3,25=\frac{n.1+(n+1)10+(n+2)5}{16}\Rightarrow n=2\)
C2H7N, C3H9N, C4H11N







