I.LÍ THUYẾT
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Quy ước cách viết cấu hình electron nguyên tử:
+ Số thứ tự lớp electron bằng các chữ số: 1, 2, 3
+ Phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f
+ Số electron trong phân lớp được ghi bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp: s2, p6, d10…
II. CÁCH VIẾT CẤU HÌNH ELECTRON NGUYÊN TỬ
1. Thứ tự mức năng lượng.
Các electron trong nguyên tử chiếm các mức năng lượng từ thấp đến cao.
Thực nghiệm và lí thuyết đã xác định được thứ tự của các lớp và phân lớp theo theo thứ tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s…
Lưu ý: Cách nhớ mức năng lượng
* Dựa vào quy tắc ziczac đơn giản của Kletkopski
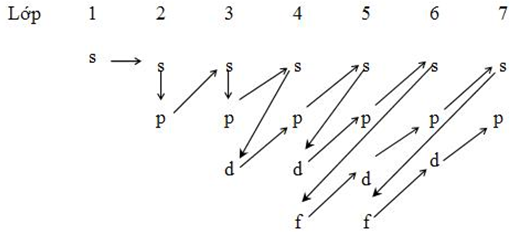
* Dựa vào sơ đồ sau:
.png)
* Hoặc sử dụng một số câu nói vui:
* Hoặc: sắn, sắn, phơi sắn, phơi sắn, đi phơi sắn, đi phơi sắn, fải đi phơi sắn, fải đi phơi sắn
s s p s p s d p s d p s f d p s f d p f
Sau đó điền số thứ tự lớp lần lượt cho s (1→7), p(2→7), d(3→6), f(4→6)
Ta được 1s2s 2p3s 3p4s 3d 4p 5s 4d 5p 6s4f 5d 6p 7s 5f 6d 7p 6f
2. Cách viết cấu hình electron nguyên tử.
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Người ta quy ước viết cấu hình electron nguyên tử như sau:
- Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3…).
- Phân lớp được ghi bằng chữ cái thường s, p, d, f.
- Số electron trong một phân lớp được ghi bằng số ở phía bên phải của phân lớp (s2, p6), các phân lớp không có electron không ghi.
Cách viết cấu hình electron nguyên tử gồm các bước sau:
Bước 1: Xác định số electron nguyên tử.
Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s…) và tuân theo quy tắc sau:
- phân lớp s chứa tối đa 2 electron;
- phân lớp p chứa tối đa 6 electron;
- phân lớp d chứa tối đa 10 electron;
- phân lớp f chứa tối đa 14 electron.
Bước 3. Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau (1s 2s 2p 3s 3p 4s 3d 4p 5s…).
VD1: Viết cấu hình electron của nguyên tử O (Z=8):
1. Xác định số electron: 8.
2. Các electron phân bố vào các phân lớp theo chiều tăng dần của năng lượng trong nguyên tử:
1s22s22p4.
3. Cấu hình electron là: 1s22s22p4.
VD2: Viết cấu hình electron của nguyên tử Fe (Z=26).
1. Xác định số electron: 26.
2. Các electron phân bố vào các phân lớp theo chiều tăng dần của năng lượng trong nguyên tử: 1s22s22p63s23p64s23d6.
3. Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau: 1s22s22p63s23p63d64s2.
Hay viết gọn là [Ar] 3d64s2.
VD3: cấu hình của một số nguyên tử khác:
1H : 1s1
2He : 1s2
3Li : 1s2 2s1
4Be : 1s2 2s2
5B : 1s2 2s2 2p1
20K : 1s2 2s2 2p6 3s2 3p64s11.
- Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s (Ví dụ nguyên tố H, Na, K...).
- Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p (Ví dụ nguyên tố B, O, Cl...).
- Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d (Ví dụ nguyên tố Fe, Cu, Cr...).
- Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f (Ví dụ nguyên tố Ce, U, Pr...).
3. Đặc điểm của lớp electron ngoài cùng
 - Lớp ngoài cùng: nsa => có enc = a ( a ≤ 2)
- Lớp ngoài cùng: nsa => có enc = a ( a ≤ 2)
nsanpb => có enc = a + b ( a + b ≤ 8)
=> số electron lớp ngoài cùng của nguyên tử luôn ≤ 8
- Các nguyên tử có 8 electron ngoài cùng là khí hiếm, chúng không tham gia vào các phản ứng hóa học.
- Các nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tử của các nguyên tố kim loại.
- Các nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim.
- Các nguyên tử có 4 electron lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại hoặc phi kim.
Như vậy, khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố.
CÂU HỎI
Câu 1: Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
A. Na+, F-, Ne. B. Na+, Cl-, Ar. C. Li+, F-, Ne. D. K+, Cl-, Ar.
Câu 2: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. kim loại. B. cộng hoá trị. C. ion. D. cho nhận.
Câu 3: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
A. phi kim và kim loại. B. kim loại và khí hiếm.
C. khí hiếm và kim loại. D. kim loại và kim loại.
Câu 4: Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là
A. [Ar]3d54s1. B. [Ar]3d64s2. C. [Ar]3d34s2. D. [Ar]3d64s1.
Câu 5: Cấu hình electron của ion Cu2+ và Cr3+ lần lượt là
A. [Ar]3d9 và [Ar]3d3. B. [Ar]3d9 và [Ar]3d14s2.
C. [Ar]3d74s2 và [Ar]3d14s2. D. [Ar]3d74s2 và [Ar]3d3.
Câu 6: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
A. 10. B. 11. C. 22. D. 23.
Câu 7: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p53s2. B. 1s22s22p63s1. C. 1s22s22p63s2. D. 1s22s22p43s1
Câu 8: Số proton và số nơtron có trong một nguyên tử nhôm (Al 2713 ) lần lượt là
A. 13 và 14. B. 13 và 15. C. 12 và 14. D. 13 và 13.
Câu 9: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
A. 8. B. 5. C. 7. D. 6.







