Dung dịch và nồng độ dung dịch
A/ LÍ THUYẾT:
1. Dung dịch: là hỗn hợp đồng nhất của dung môi và chất tan. Ở nhiệt độ xác định dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan. Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan.
- Độ tan của một chất trong nước:
Độ tan (S) của một chất là số gam chất đó tan trong 100g nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định. Độ tan tăng khi nhiệt độ tăng.
S = 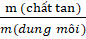 .100
.100
2. Nồng độ dung dịch:
a) Nồng độ phần trăm:
C% = 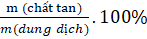
b) Nồng độ mol:
CM =  (mol/lít)
(mol/lít)
c) Mối liên hệ giữa nồng độ mol và nồng độ phần trăm:
CM = 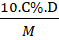
D: khối lượng riêng của dung dịch (g/ml)
M: khối lượng mol chất tan.
B/ Bài tập ví dụ:
1. Ở 20oC, hòa tan 14,36g muối ăn vào 40g nước được dung dịch bão hòa. Tính độ tan của muối ăn ở nhiệt độ đó và nồng độ phần trăm của dung dịch bão hòa.
Áp dụng công thức đã cho:
Độ tan S = (14,36x100)/40 = 35,9
C% = (100x35,9)/(100+35,9) = 26,4%
2. Tính khối lượng CuSO4 trong 500g CuSO4.5H2O
Giải: MCuSO4.5H2O = 250 g.
Cứ 250 gam tinh thể có 160g CuSO4 => 500 g tinh thể có: (160x500)/250 = 320 gam CuSO4
3. Cần bao nhiêu gam tinh thể CuSO4.5H2O và bao nhiêu gam dung dịch CuSO4 8% để điều chế 280 gam dung dịch CuSO4 16%
Giải:
Gọi x (g) là khối lượng tinh thể. y (g) là khối lượng dung dịch 8%
- Khối lượng dung dịch tạo thành : x+y= 280 (I)
Khối lượng CuSO4 trong tinh thể là 160x/250 = 0,64x (g)
Khối lượng CuSO4 trong dung dịch 8%: 8y/100 = 0,08y (g)
Khối lượng CuSO4 trong dung dịch tạo thành là (280x16)/100 = 44,8 g
- 0,64x + 0,08y = 44,8 (II)
Từ (I) và (II) suy ra x = 40, y = 240.
C/ Bài tập tự giải:
1. Tính % khối lượng của nước trong tinh thể CuSO4.5H2O
2. Tính lượng CuSO4.5H2O cần dùng để điều chế 500ml dung dịch CuSO4 8% (D = 1,1 g/ml)
3. Có bao nhiêu gam tinh thể Fe(NO3)3.6H2O kết tinh được từ 500ml dung dịch Fe(NO3)3 0,1M
4, Hòa tan 5,6 lít khí HCl (đktc) vào 0,1 lít H2O để tạo ra dung dịch HCl. Tính nồng độ mol và nồng độ phần trăm của dung dịch đó.







