I. OXI
1. Tính chất vật lí
- Là chất khí không màu, không mùi, nặng hơn không khí, ít tan trong nước. Oxi lỏng có màu xanh nhạt.
2. Tính chất hóa học
- Là một phi kim hoạt động (do có độ âm điện lớn, chỉ kém F)
* Tác dụng với kim loại
- Tác dụng với hầu hết các kim loại (trừ Ag, Au, Pt) tạo thành oxit. Các phản ứng thường xảy ra ở nhiệt độ cao
$3F\text{e}+2{{\text{O}}_{2}}\xrightarrow{{{t}^{o}}}F{{\text{e}}_{3}}{{O}_{4}}$
* Tác dụng với phi kim
- Oxi phản ứng với hầu hết các phi kim (trừ halogen)
.png)
* Tác dụng với hợp chất có tính khử
$4F\text{e}{{S}_{2}}+11{{\text{O}}_{2}}\xrightarrow{{{t}^{o}}}2F{{\text{e}}_{2}}{{O}_{3}}+8\text{S}{{O}_{2}}$
3. Ứng dụng
- Có vai trò quyết định đối với sự sống của người và động vật. Oxi không thể thiếu đối với quá trình hô hấp.
- Oxi cũng được dùng nhiều trong công nghiệp hóa chất, luyện thép, y khoa, hàn cắt kim loại...
II. OZON
Oxi (O2) và ozon (O3) là hai dạng hình thù của nguyên tố oxi.
1. Cấu tạo phân tử của ozon
Phân tử ozon có ba nguyên tử oxi liên kết với nhau. Nguyên tử oxi trung tâm tạo nên một liên kết cho - nhận với một trong hai nguyên tử oxi và hai liên kết cộng hóa trị với nguyên tử oxi còn lại:
.png)
2. Tính chất của ozon
a) Tính chất vật lí
- Ozon là chất khí, mùi đặc trưng, màu xanh nhạt.
- Ở nhiệt độ −1120C, khí ozon hóa lỏng có màu xanh đậm. Ozon tan trong nước nhiều hơn oxi gần 16 lần (100 ml nước ở 00C hòa tan được 49 ml khí ozon).
b) Tính chất hóa học
- Trên tầng cao của khí quyển, O3 được tạo thành từ O2 do ảnh hưởng của tia cực tím (UV) hoặc sự phóng điện trong cơn dông:
3O2 \(\xrightarrow{UV}\) 2O3
- O3 là một trong những chất có tính oxi hóa rất mạnh và mạnh hơn O2.
Thí dụ:
- Ozon oxi hóa được hầu hết các kim loại trừ Au và Pt. Ở điều kiện bình thường, O2 không oxi hóa được Ag, nhưng O3 oxi hóa Ag thành Ag2O:
2Ag + O3 → Ag2O + O2
- O3 không oxi hóa được ion I− trong dung dịch, nhưng O3 oxi hóa ion I− thành I2:
2KI + O3 + H2O → I2 + 2KOH + O2 (dung dịch thu được làm xanh hồ tinh bột)
3. Ứng dụng của ozon
- Không khí chứa một lượng rất nhỏ ozon có tác dụng làm cho không khí trong lành. Với lượng ozon lớn hơn sẽ gây độc hại với con người.
- Trong thương mại, người ta dùng ozon để tẩy trắng các loại tinh bột, dầu ăn và nhiều chất khác.
- Trong đời sống, người ta dùng ozon để khử trùng nước ăn, khử mùi, bảo quản hoa quả. Trong y khoa, ozon được dùng chữa sâu răng.
III. HIĐRO PEOXIT
1. Cấu tạo phân tử của hiđro peoxit
Hiđro peoxit (nước oxi già) có công thức phân tử là H2O2. Công thức cấu tạo của phân tử là:
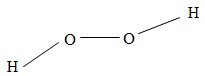
Liên kết giữa các nguyên tử H và nguyên tử O là liên kết cộng hóa trị có cực (cặp electron chung lệch về phía nguyên tử O).
2. Tính chất của hiđro peoxit
a) Tính chất vật lí
Hiđro peoxit là chất lỏng không màu, nặng hơn nước (D = 1,45 g/cm3), hóa rắn ở −0,480C, tan trong nước theo bất kì tỉ lệ nào.
b) Tính chất hóa học
- Hiđro peoxit là hợp chất ít bền, dễ bị phân hủy thành H2O và O2:
2H2O2 \(\xrightarrow{Mn{{O}_{2}}}\) 2H2O + O2↑
=> Phản ứng này được dùng để điều chế oxi trong phòng thí nghiệm.
- Số oxi hóa của nguyên tố oxi trong H2O2 là −1, là số oxi hóa trung gian giữa các số oxi hóa −2 và 0 của nguyên tố oxi => H2O2 vừa có tính oxi hóa, vừa có tính khử:
+ H2O2 có tính oxi hóa khi tác dụng với chất khử. Thí dụ:
H2O2 + KNO2 → H2O + KNO3
H2O2 + 2KI → I2 + 2KOH
+ H2O2 có tính khử khi tác dụng với chất oxi hóa. Thí dụ:
Ag2O + H2O2 → 2Ag + H2O + O2
5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
3. Ứng dụng của hiđro peoxit
- Dùng làm chất tẩy trắng, chất bảo vệ môi trường, khai thác mỏ.
- Dùng trong các ngành công nghiệp hóa chất, khử trùng hạt giống trong nông nghiệp, chất bảo quản nước giải khát, trong y khoa dùng làm chất sát trùng (dung dịch H2O2 3%),...







