- Khi giải bài tập về phần này cần xác định bài đó thuộc dạng nào trong 4 dạng sau:
+ Dạng 1: Một kim loại tác dụng với 1 muối
+ Dạng 2: Một kim loại tác dụng với hỗn hợp muối
+ Dạng 3: Hỗn hợp kim loại tác dụng với 1 muối
+ Dạng 4: Hỗn hợp kim loại tác dụng với hỗn hợp muối
Nguyên tắc chung: Kim loại có tính khử mạnh hơn sẽ tác dụng với muối có gốc cation kim loại có tính oxi hóa mạnh hơn theo quy tắc $\alpha $.
- Cần xác định kim loại nào phản ứng với muối nào trước.
- Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
- Cần ghi nhớ 1 số phản ứng hay gặp
2Fe3+ + Fe → 3Fe2+
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Fe2+ + Ag+ → Ag + Fe3+
I. BÀI TOÁN 1 KIM LOẠI TÁC DỤNG VỚI 1 MUỐI
.png)
- Điều kiện của phản ứng:
- A phải đứng trước B trong dãy điện hóa.
- Muối B phải tan:
Ví dụ: Fe + Cu2+ → Fe2+ + Cu
Nhưng: Fe + Al3+ không xảy ra do tính khử của Fe yếu hơn Al3+
Hay Cu + AgCl không xảy ra do AgCl không tan
- Phương pháp giải:
+) Sử dụng tăng giảm khối lượng
- Nếu ${{\text{m}}_{\text{B}\downarrow }}$> ${{\text{m}}_{\text{A tan}}}$ thì khối lượng thanh kim loại A tăng: Độ tăng khối lượng = ${{\text{m}}_{\text{B}\downarrow }}$- ${{\text{m}}_{\text{A tan}}}$
- Nếu ${{\text{m}}_{\text{B}\downarrow }}$< ${{\text{m}}_{\text{A tan}}}$ thì khối lượng thanh kim loại A giảm: Độ giảm khối lượng = ${{\text{m}}_{\text{A tan}}}$- ${{\text{m}}_{\text{B}\downarrow }}$
+) sử dụng bảo toàn e: ne kim loại cho = ne cation nhận
II. BÀI TOÁN 1 KIM LOẠI TÁC DỤNG VỚI 2 MUỐI
.png)
- Điều kiện của phản ứng:
- A phải đứng trước B và C trong dãy điện hóa.
- Muối ${{\text{B}}^{\text{n+}}}$, ${{\text{C}}^{\text{m+}}}$ phải tan.
- Phương pháp giải
- Nếu biết số mol ban đầu của $A$, ${{\text{B}}^{\text{n+}}}$, ${{\text{C}}^{\text{m+}}}$ta chú ý đến thứ tự phản ứng và sử dụng bảo toàn e
- Nếu biết số mol ban đầu của ${{\text{B}}^{\text{n+}}}$, ${{\text{C}}^{\text{m+}}}$nhưng không biết số mol ban đầu của A ta có thể dùng phương pháp mốc so sánh nếu biết khối lượng của chất rắn sau phản ứng (m):
- Mốc 1 (vừa đủ phản ứng 1.): mrắn = ${{\text{m}}_{\text{C}}}\text{ = }{{\text{m}}_{\text{1}}}$
- Mốc 2 (vừa đủ phản ứng 2.): mrắn = ${{\text{m}}_{\text{C}}}\text{ + }{{\text{m}}_{\text{B}}}\text{ = }{{\text{m}}_{\text{2}}}$
So sánh m với m1 và m2 :
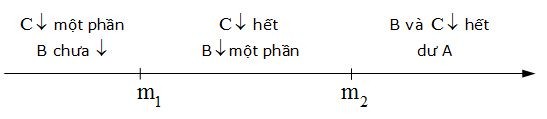
Như vậy có 3 trường hợp có thể xảy ra:
+ Trường hợp 1: Nếu m < ${{\text{m}}_{\text{1}}}$ dư ${{\text{C}}^{\text{m+}}}$ chỉ có phản ứng 1. Dung dịch sau phản ứng có ${{\text{A}}^{\text{p+}}}$ ,${{\text{B}}^{\text{n+}}}$ chưa phản ứng và ${{\text{C}}^{\text{m+}}}$ dư. Chất rắn sau phản ứng chỉ có $\text{C}$.
+ Trường hợp 2: Nếu ${{\text{m}}_{\text{1}}}$ < m < ${{\text{m}}_{\text{2}}}$ xong phản ứng 1, phản ứng 2 xảy ra một phần dư ${{\text{B}}^{\text{n+}}}$. Dung dịch sau phản ứng có ${{\text{A}}^{\text{p+}}}$ ,${{\text{B}}^{\text{n+}}}$ dư. Chất rắn sau phản ứng có $\text{C}$ và B.
+ Trường hợp 3: Nếu m > ${{\text{m}}_{\text{2}}}$ xong phản ứng 1, xong phản ứng 2 dư A. Dung dịch sau phản ứng có ${{\text{A}}^{\text{p+}}}$. Chất rắn sau phản ứng có $\text{C}$, B và A dư.







