SILIC VÀ HỢP CHẤT CỦA SILIC
PHẦN I: LÝ THUYẾT
I)
SILIC
Silic có cấu hình
electron là : 1s22s22p63s23p2.
Silic thuộc nhóm IVA, chu kỳ 3 trong bảng hệ thống tuần hoàn.
1)
Tính chất vật lý:
-Silic có hai dạng thù
hình là silic vô định hình và silic tinh thể.
-Silic vô định hình: là
chất bột màu nâu, không tan trong nước nhưng tan trong kim loại nóng chảy.
- Silic tinh thể: có màu xám, có ánh
kim, có cấu trúc giống kim cương nên có tính bán dẫn.
2) Tính chất hóa học:
- Các mức oxi hóa có thể có của Si:
-4; 0; +2; +4 (số oxi hóa +2 ít đặc trưng) nên Si có cả tính khử và tính oxi
hoá.
-
Silic vô định hình có khả năng phản ứng cao hơn silic tinh thể.
a. Tính khử
- Tác dụng với phi kim:
Si + 2F2 \[\xrightarrow{{}}\]
SiF4 (phản ứng xảy ra ở nhiệt độ thường)
Si + 2O2 \[\xrightarrow{{}}\]SiO2
(400 – 600oC)
- Tác dụng với hợp chất:
+ Si tan dễ dàng trong dung dịch kiềm \[\xrightarrow{{}}\]
H2
Si + 2NaOH + H2O \[\xrightarrow{{}}\]
Na2SiO3 + 2H2
+ Si tác dụng với axit
4HNO3 + 18HF + 3Si \[\xrightarrow{{}}\] 3H2SiF6 + 4NO + 8H2O
- Trong hồ quang điện, Silic tác dụng
với H2 tạo thành một hỗn hợp các silan:
Si + H2 \[\xrightarrow{{}}\]
SiH4 + Si2H6 + Si3H6 +
...
b. Tính oxi hóa
Si tác dụng được với nhiều kim loại ở nhiệt
độ cao \[\xrightarrow{{}}\] silixua kim loại.
2Mg + Si \[\xrightarrow{{}}\] Mg2Si
3. Điều chế
SiO2 + C Than cốc \[\xrightarrow{{{1800}^{o}}C}\]
2CO + Si
SiO2
+ 2Mg \[\xrightarrow{{}}\] 2MgO + Si (có thể thay Mg bằng Al)
SiCl4 + 2Zn \[\xrightarrow{{}}\]
Si + 2ZnCl2
SiH4
\[\xrightarrow{{{t}^{o}}}\] Si + 2H2
SiI4 \[\xrightarrow{{{t}^{o}}}\] Si + 2I2
\[II\]) Silic đioxit (SiO2)
1. Tính chất vật lí và trạng
thái tự nhiên
- Là chất ở
dạng tinh thể nguyên tử, không tan trong nước.
- Trong tự
nhiên chủ yếu tồn tại ở dạng khoáng vật thạch anh.
2. Tính chất hoá học
- SiO2 có tính chất của oxit axit, tan chậm trong dung dịch kiềm và tan dễ trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy \[\xrightarrow{{}}\] silicat:
SiO2 + 2NaOH \[\xrightarrow{{}}\] Na2SiO3 + H2O
SiO2 + Na2CO3
\[\xrightarrow{{}}\] Na2SiO3 + CO
- SiO2 tan dễ trong axit HF:
SiO2 + 4HF \[\xrightarrow{{}}\]
SiF4 + 2H2O
Phản ứng này dùng để khắc chữ trên thủy tinh \[\xrightarrow{{}}\] không dùng bình thủy tinh để đựng axit HF.
\[III\])Axit Slicic và
muối silicat
1.Axit H2SiO3
- Dạng keo, không tan trong nước, khi đun nóng dễ bị mất nước:
H2SiO3
\[\xrightarrow{{{t}^{o}}}\] H2O + SiO2
- Khi sấy khô, H2SiO3 mất một phần nước
tạo thành vật liệu xốp là silicagen được dùng làm chất hút ẩm và hấp phụ nhiều
chất.
- H2SiO3 chỉ tác dụng với dung dịch kiềm
mạnh.
H2SiO3
+ 2NaOH \[\xrightarrow{{}}\] Na2SiO3 + 2H2O
- Là axit yếu, yếu hơn axit cacbonic nên điều chế bằng cách
dùng axit mạnh đẩy ra khỏi muối hoặc thủy phân một số hợp chất của Si.
Na2SiO3
+ 2HCl \[\xrightarrow{{}}\] 2NaCl + H2SiO3
Na2SiO3+ CO2 + H2O \[\xrightarrow{{}}\] H2SiO3 + Na2CO3
2. Muối
silicat
Là muối của axit
silicic thường không màu, khó tan (trừ muối kim loại kiềm tan được).
- Dung dịch đậm đặc của Na2SiO3 được gọi
là thủy tinh lỏng được dùng để chế tạo keo dán thủy tinh và sứ, bảo quản vải và
gỗ khỏi bị cháy. Trong dung dịch, silicat của kim loại kiềm bị thủy phân mạnh tạo
môi trường bazơ:
Na2SiO3 + 2H2O
\[\xrightarrow{{}}\] 2Na+ + 2OH‑ + H2SiO3-
IV. Công nghiệp silicat
1. Thủy tinh
- Là hỗn hợp
của natri silicat, canxi silicat và silic đioxit có thành phần gần đúng được viết
dưới dạng các oxit là Na2O.CaO.6SiO2.
- Sản xuất
thủy tinh bằng cách nấu chảy hỗn hợp cát trắng, đá vôi và sôđa ở 1400oC:
6SiO2+ CaCO3 + Na2CO3 \[\xrightarrow{{}}\] Na2O.CaO.6SiO2 + 2CO2
- Thủy tinh
là chất vô định hình không có nhiệt độ nóng chảy xác định. Khi đun nóng nó mềm
ra rồi mới chảy.
- Một số loại
thủy tinh:
+ Thủy tinh thông thường (như trên).
+ Thủy tinh Kali: Thay Na2CO3
bằng K2CO3.
+ Thủy tinh phalê: chứa nhiều chì oxit.
+ Thủy tinh thạch anh: sản xuất bằng cách nấu
chảy SiO2 tinh khiết.
+ Thêm các oxit kim loại vào sẽ tạo ra các loại thủy tinh có màu sắc khác nhau.
2. Đồ gốm
Chủ yếu được tạo thành từ đất sét và cao
lanh.
- Các loại đồ
gốm:
+ Gạch và ngói: thuộc loại gốm xây dựng
được sản xuất bằng cách đem đất sét và cát nhào với nước thành một khối dẻo, tạo
hình rồi sấy khô, nung ở 900 – 1000oC. Gạch và ngói thường có màu đỏ
là màu của oxit sắt có trong đất sét.
+ Gạch chịu lửa: gồm 2 loại chính là gạch
đinat và gạch samôt. Gạch đinat gồm 93 - 96% SiO2; 4 - 7%CaO và đất
sét nung ở khoảng 1300 – 1400oC. Gạch samôt gồm bột samôt trộn với đất
sét và nước đem đóng khuôn và sấy khô, vật liệu được nung ở 1300 – 1400oC
+ Sành: là đất sét sau khi nung ở nhiệt
độ 1200 – 1300oC
+ Sứ: được sản xuất từ cao lanh,
fenspat, thạch anh và một số oxit kim loại. Đồ sứ được nung 2 lần, lần đầu ở
1000oC, sau đó tráng men và trang trí rồi nung lần thứ 2 ở nhiệt độ
khoảng 1400 – 1450oC.
+ Men : Có thành phần chính gần giống sứ nhưng dễ nóng chảy hơn.
3. Xi măng
- Thành phần
hóa học chính của xi măng pooclăng là canxi silicat và canxi aluminat: Ca3SiO5
hoặc (3CaO.SiO2), Ca2SiO4 (hoặc 2CaO.SiO2),
Ca3(AlO3)2 (hoặc 3CaO.Al2O3).
- Cách sản
xuất: Nghiền nhỏ đá vôi trộn với đất sét có nhiều SiO2 và một ít quặng
sắt bằng phương pháp khô hoặc phương pháp ướt rồi nung hỗn hợp trong lò quay hoặc
lò đứng ở 1400 – 1600oC \[\xrightarrow{{}}\] hỗn hợp màu xám là
clanhke. Để nguội, nghiền clanke với các chất phụ gia thành bột mịn \[\xrightarrow{{}}\]
xi măng.
- Quá trình đông cứng của xi măng: chủ yếu là sự kết hợp của các hợp chất có trong xi măng với nước tạo thành những tinh thể hiđrat đan xen nhau tạo thành khối cứng và bền:
3CaO.SiO2 + 5H2O \[\xrightarrow{{}}\]Ca2SiO4.4H2O + Ca(OH)2
2CaO.SiO2 + 4H2O
\[\xrightarrow{{}}\] Ca2SiO4.4H2O
3CaO.Al2O3 + 6H2O \[\xrightarrow{{}}\] Ca3(AlO3)2.6H2O
PHẦN II: BÀI TẬP
Câu 1: Nguyên
tử cacbon và silic giống nhau về:
A .Cấu hình
electron B .số
electron ở lớp ngoài cùng
C .Số lớp
electron D . Số
điện tích hạt nhân
Câu 2: Trong
các phản ứng sau( theo thư tự), Si là chất oxi hóa hay chất khử?
Si + 2KOH + H2O\[\xrightarrow{{}}\]K2SiO3
+ 2H2 (1)
Si + 2F2\[\xrightarrow{{}}\]SiF4
(2)
A . đều là chất khử B .đều là chất oxi
hóa
C .chất khử và chất oxi hóa D .Chất oxi hóa và chất khử.
Câu 3: Silic
đioxit phản ứng được các chất trong daxy nào sau đây?
A . NaOH,
MgO, HCl B .KOH,
MgCO3, HF
C .NaOH, Mg,
HF D .KOH, Mg, HCl
Câu 4:
Phương trình ion thu gọn :
2H+ + SiO32-
\[\xrightarrow{{}}\]H2SiO3(\[\downarrow \]) là của phản ứng
hóa học xảy ra giữa:
A .H2CO3
và Na2SiO3 B .H2CO3
và K2SiO3
C .HCl và
CaSiO3 D .HCl và Na2SiO3
Câu 5: Chọn
hóa chất có thể hòa tan được Si và Al:
A .KOH
B .HCl
C .H2SO4 (loãng) D .dung dịch NH3
Câu 6: Chọn
phát biểu đúng về silicat:
A .Thủy tinh
có cấu trúc vô định hình nên nhiệt độ nóng chảy xác định.
B .Xi măng
là vật liệu dung trong xây dựng, là loại vật liệu không kết dính.
C .Thủy
tinh, sành sứ, xi măng đều có chứa một số muối silicat trong thành phần.
D .Sứ là loại
gốm dân dụng, gốm kỹ thuật và gốm xây dựng.
Câu 7: Để khắc
chữ và hình lên thủy tinh, ta dung:
A .HCl đặc
B .HBr
C .H2SO4 đặc D .HF
Câu 8:Một loại thủy tinh dung để chế tạo công cụ nhà bếp chứa
16% Na2O, 9%CaOvà 75% SiO2 về khối lượng.Trong loại thủy
tinh này, 1 mol CaO kết hợp với :
A . 1,6125 mol Na2O và 7,8125 mol SiO2
B . 1,6 mol Na2O và 7,77 mol SiO2
C . 2 mol Na2O và 6 mol SiO2
D .1 mol Na2O và 6 mol SiO2
Câu 9: Thủy tinh không có cấu trúc tinh thể mà là chất vô định
hình, nên thủy tinh:
A .có hệ số nở nhiệt rất nhỏ
B . có nhiều màu sắc khác nhau
C .trong suốt
D . không có nhiệt độ nóng chảy xác định.
Câu 10: Khối lượng Na2CO3 cầ dung để sản
xuất 120kg thủy tinh( Na2O.CaO.6SiO2) với hiệu suất 90%
là:
A .25,38 kg
B .29,56 Kg
C .30,52 Kg D 32,64
Kg
ĐÁP ÁN: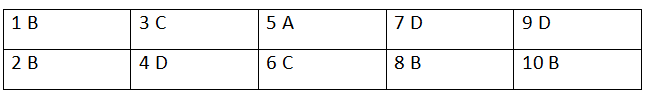
Câu 5: Si + 2KOH + H2O\[\xrightarrow{{}}\]K2SiO3
+ 2H2
2Al + 2KOH
+ 2H2O\[\xrightarrow{{}}\]2KAlO2 + 3H2
Câu 10: mthủy tinh lý thuyết=\[\frac{120\,.\,100}{90}=\frac{400}{3}\]
kg
Ta có phương trình:
6SiO2
+ CaCO3 + Na2CO3\[\xrightarrow{{}}\]Na2O.CaO.6SiO2
+ 2CO2
106 gam 478 gam
m Na2CO3
400/3 kg
=>m Na2CO3= 29,56 kg







