I. TÓM TẮT LÍ THUYẾT
1. Hợp chất Sắt (II)
Tính chất hoá học cơ bản của hợp chất sắt (II) là tính khử.
Fe2+ → Fe3+ + 1e
|
Đặc điểm |
Sắt (II) oxit |
Sắt (II) hidroxit |
Muối Sắt (II) |
|
Tính chất vật lí |
FeO là chất rắn, màu đen. |
Fe(OH)2 nguyên chất là chất rắn, màu trắng hơi xanh, không tan trong nước |
Tan trong nước, đa số kết tinh thường ở dạng ngậm nước. Ví dụ: FeSO4.7H2O; FeCl2.4H2O |
|
Tính chất hóa học |
\(3FeO+10HNO_{3}\overset{t^{0}}{\rightarrow}\) \(3Fe(NO_{3})_{3}+NO+5H_{2}O\) |
FeCl2 + 2NaOH \[\to \] Fe(OH)2\[\downarrow \] + 2 NaOH 4Fe(OH)2 + O2 + 2H2O \[\to \] 4Fe(OH)3\[\downarrow \] |
\(FeCl_{2} +2Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\) |
|
Điều chế |
\(Fe_{2}O_{3}+CO\overset{t^{0}}{\rightarrow}2FeO+CO_{2}\uparrow\) |
Điều chế trong điều kiện không có không khí \({FeC{l_2} + {\rm{ }}2NaOH{\rm{ }} \to {\rm{ }}Fe{{\left( {OH} \right)}_2} \downarrow + {\rm{ }}2NaCl}\) |
Cho Fe (hoặc FeO; Fe(OH)2) tác dụng với HCl hoặc H2SO4 loãng. Fe + 2HCl \[\to \] FeCl2 + H2\[\uparrow \] FeO + H2SO4 \[\to \] FeSO4 + H2O *Dung dịch muối sắt (II) điều chế được phải dùng ngay vì trong không khí sẽ chuyển dần thành muối sắt (III). |
2. Hợp chất của Sắt (III)
Tính chất hoá học đặc trưng của hợp chất sắt (III) là tính oxi hoá.
Fe3+ + 1e → Fe2+
Fe3+ + 2e → Fe
|
|
|||
|
Đặc điểm |
Sắt (III) oxit |
Sắt (III) hidroxit |
Muối Sắt (III) |
|
Tính chất vật lí |
Fe2O3 là chất rắn màu đỏ nâu, không tan trong nước |
Fe(OH)3 là chất rắn, màu nâu đỏ, không tan trong nước |
Đa số các muối sắt (III) tan trong nước, khi kết tinh thường ở dạng ngậm nước. Ví dụ: FeCl3.6H2O; Fe2(SO4)3.9H2O |
|
Tính chất hóa học |
\(F{e_2}{O_3} + {\rm{ }}6HCl{\rm{ }} \to {\rm{ }}2FeC{l_3} + {\rm{ }}3{H_2}O\) \(Fe_{2}O_{3}+CO\overset{t^{0}}{\rightarrow}2FeO+CO_{2}\uparrow\) |
\(2Fe{\left( {OH} \right)_3} + {\rm{ }}3{H_2}S{O_4} \to {\rm{ }}F{e_2}{\left( {S{O_4}} \right)_3} + {\rm{ }}6{H_2}O\) |
\(Fe+2FeCl_{3}\rightarrow 3FeCl_{2}\) \(Cu+2FeCl_{3}\rightarrow CuCl_{2}+2FeCl_{2}\) |
|
Điều chế |
\(Fe(OH)_{3}\overset{t^{0}}{\rightarrow}Fe_{2}O_{3}+3H_{2}O\) |
Dung dịch kiềm + dung dịch muối sắt (III) \(FeC{l_3} + {\rm{ }}3NaOH{\rm{ }} \to {\rm{ }}Fe{\left( {OH} \right)_3} \downarrow + {\rm{ }}3NaCl\)
|
|
II. GIẢI BÀI TẬP SÁCH GIÁO KHOA
Câu 1. (Trang 145 SGK)
Viết phương trình hóa học của các phản ứng trong quá trình chuyển đổi sau :
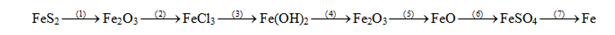
Bài làm:
(1) 4FeS2 + 11O2 →(to) 2Fe2O3 + 8SO2
(2) Fe2O3 + 6HCl → 2FeCl3 + 3H2O
(3) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(4) 2Fe(OH)3 →(to) Fe2O3 + 3H2O.
(5) Fe2O3 + 3CO →(to) 2Fe + 3CO2.
(6) FeO + H2SO4 → FeSO4 + H2O.
(7) FeSO4 + Mg → MgSO4 + Fe.
Câu 2. (Trang 145 SGK)
Cho sắt tác dụng với dung dịch H2SO4 loãng thu được V lít khí H2 (đktc), dung dịch thu được cho bay hơi thu được tinh thể FeSO4.7H2O có khối lượng là 55,6 gam. Thể tích khí H2(đktc) được giải phóng là :
A.8,19 lít.
B.7,33 lít.
C.4,48 lít.
D.6,23 lít.
Bài làm:
Ta có : nFe=nFeSO4.7H2O=\[\frac{55,6}{278}\]=0,2 (mol)
PTHH: Fe + H2SO4 → FeSO4 + H2
Theo phương trình phản ứng trêb trên ta có nFe = nH2 = 0,2 (mol)
Vậy thể tích khí VH2= 0,2.22,4 = 4,48 (lít)
Câu 3. (Trang 145 SGK)
Ngâm một đinh sắt nặng 4 gam trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857 gam. Khối lượng sắt tham gia phản ứng là :
A. 1,9990 gam
B. 1,9999 gam.
C. 0,3999 gam
D. 2,1000 gam.
Bài làm:
Đáp án B
Fe + CuSO4 → FeSO4 + Cu
Cứ 56 gam Fe phản ứng tạo 64 gam Cu
=> khối lượng thanh sắt tăng : 64 – 56 = 8 (gam)
Khối lượng thanh sắt tăng là 4,2857 – 4 = 0,2857 (gam).
=>nFe = nCu = \[\frac{0,2857}{8}\] = 0,0357 (mol)
Khối lượng sắt phản ứng là: 0,0357.56 = 1,99 (g)
Câu 4. (Trang 145 SGK)
Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là
A.231 gam.
B.232 gam.
C.233 gam.
D. 234 gam.
Bài làm:
Đáp án B
Khối lượng của hỗn hợp A là 0,5.( 72 + 160 + 232) = 232 gam.
Câu 5. (Trang 145 SGK)
Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là
A.15 gam.
B.20 gam.
C.25 gam.
D.30 gam.
Bài làm:
PTHH
Fe2O3 + 3CO → 2Fe + 3CO2
Do Ca(OH)2 dư nên chỉ xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
Ta có : nFe2O3=0,1 (mol)
Theo phương trình phản ứng =>nCaCO3 = nCO2 = 3nFe2O3 = 0,3 (mol)
=>mCaCO3 = 0,3.100 = 30 (g)







