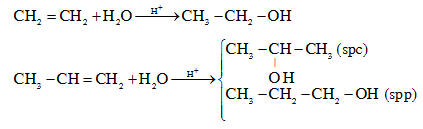I. ĐIỀU CHẾ
1. Phương pháp tổng hợp
a. Từ anken + H2O xúc tác H+ (H2SO4 hoặc H3PO4)
Cộng theo quy tắc Maccopnhicop: phần H cộng vào C mang nhiều H hơn, còn nhóm –OH cộng vào C mang ít H.
b. Thủy phân dẫn xuất halogen
${{C}_{2}}{{H}_{5}}Cl+NaOH\xrightarrow{{{t}^{o}}}{{C}_{2}}{{H}_{5}}OH+NaCl$
c. Oxi hóa không hoàn toàn
$2C{{H}_{4}}+{{O}_{2}}\xrightarrow{Cu/{{200}^{o}}C,100atm}2C{{H}_{3}}OH$
$CO+2{{H}_{2}}\xrightarrow[{{400}^{o}}C,\text{ }200atm]{ZnO,\text{ }Cr{{O}_{3}}}C{{H}_{3}}OH$
Dùng điều chế CH3OH trong công nghiệp.
d. Anđehit (xeton) + H2
Anđehit + H2 $\xrightarrow{{{t}^{0}},Ni}$ancol bậc 1
Xeton + H2 $\xrightarrow{{{t}^{0}},Ni}$ancol bậc 2
Ví dụ: CH3CHO + H2 $\xrightarrow{{{t}^{0}},Ni}$CH3CH2OH
CH3COCH3 + H2 $\xrightarrow{{{t}^{0}},Ni}$CH3CH(OH)CH3
e. Phương pháp sinh hóa
Sản xuất ancol etylic từ tinh bột theo sơ đồ:
.png)
.png)
II. ỨNG DỤNG
1) Ứng dụng của etanol
- Làm nguyên liệu để sản xuất các hợp chất khác như đietyl ete, axit axetic, etyl axetat,...
- Làm dung môi để pha chế vecni, dược phẩm, nước hoa,...
- Làm nhiên liệu
2) Ứng dụng của metanol
- Nguyên liệu để sản xuất anđehit fomic, metylamin, metyl clorua,...
* Metanol là chất rất độc, chỉ cần một lượng nhỏ vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong.
III. BÀI TOÁN ĐỘ RƯỢU
.png)
m = V . D
Trong đó:
V là thể tích dung dịch, thường dùng đơn vị là ml.
D là khối lượng riêng thường có đơn vị là g/ml.
${{m}_{{{C}_{2}}{{H}_{5}}OH}}={{V}_{{{C}_{2}}{{H}_{5}}OH}}.{{D}_{{{C}_{2}}{{H}_{5}}OH}}$
${{m}_{{{H}_{2}}O}}={{V}_{{{H}_{2}}O}}.{{D}_{{{H}_{2}}O}}={{V}_{{{H}_{2}}O}}.1\,\,({{D}_{{{H}_{2}}O}}\approx 1g/ml)$
Khi cho hỗn hợp ancol và nước phản ứng với kim loại kiềm thì nước phản ứng trước.