CHƯƠNG 1: CÁC LOẠI HỢP CHẤT VÔ CƠ
Bài 7: Tính chất hóa học của bazơ
- Kiến thức cần nhớ:
- Tính chất hoá học chung của bazơ (tác dụng với chất chỉ thị màu và với axit) ; tính chất hoá học riêng của bazơ tan (kiềm) (tác dụng với oxit axit và với dung dịch muối) ; tính chất hoá học riêng của bazơ không tan trong nước (bị nhiệt phân hủy). Tra bảng tính tan để biết một số bazơ cụ thể thuộc loại kiềm hoặc bazơ không tan.
- Quan sát thí nghiệm, rút ra kết luận về tính chất của bazơ và tính chất riêng của bazơ không tan. Nhận biết môi trường dung dịch bằng chất chỉ thị màu (giấy quỳ tím hoặc dung dịch phenolphtalein).
- Viết các pthh minh họa tính chất hoá học của bazơ.
- Tính khối lượng hoặc thể tích dung dịch bazơ tham gia phản ứng.
- Lý thuyết:
- Khái niệm và phân loại:
Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (OH).
- Hóa trị của kim loại bằng số nhóm hidroxit
- Tên bazơ = tên kim loại (thêm hóa trị, nếu kim loại có nhiều hóa trị) + hidroxit
Ví dụ: NaOH: Natri hidroxit
Fe(OH)3: Sắt (III) hidroxit
- Dựa vào tính tan của bazơ trong nước, người ta chia bazơ thành 2 loại:
- Bazơ tan được trong nước tạo thành dung dịch bazơ (gọi là kiềm):
Ví dụ: NaOH, KOH, Ba(OH)2, Ca(OH)2, LiOH, RbOH, CsOH, Sr(OH)2.
- Những bazơ không tan:
Ví dụ: Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
- Tính chất hóa học
- Tác dụng với chất chỉ thị màu.
- Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
- Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
- Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
- Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
- Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Lưu ý: Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
- Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Ví dụ: Cu(OH)2 -> CuO + H2O (t0)
2Fe(OH)3 -> Fe2O3 + 3H2O (t0)
- Ví dụ minh họa:
Bài 1:
Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
Giải:
- Vì kiềm là một loại bazơ tan được trong nước nên tất cả các chất kiềm đều là bazơ.
Ví dụ: NaOH, KOH, Ba(OH)2.
- Vì không phải mọi bazơ đều tan trong nước nên không phải tất cả các bazơ đều là chất kiềm.
Ví dụ: Các bazơ Cu(OH)2,Mg(OH)2, Fe(OH)3 .. là các bazơ không tan
Bài 2:
Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào
- Tác dụng được với với dung dịch HCl.
- Bị nhiệt phân hủy.
- Tác dụng được CO2.
- Đổi màu quỳ tím thành xanh.
Giải:
- Tất cả các bazơ đều tác dụng với axit HCl:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
- Chỉ có Cu(OH)2 là bazơ không tan nên bị nhiệt phân hủy:
Cu(OH)2 → CuO + H2O (to)
- Những bazơ tác dụng với CO2 là NaOH và Ba(OH)2.
2NaOH + CO2 → Na2CO3 + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
- Những bazơ đổi màu quỳ tím thành màu xanh là NaOH và Ba(OH)2.
Bài 3:
Từ những chất có sẵn là Na2O, CaO,_ H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
Giải:
Phương trình hóa học điều chế các dung dịch bazơ:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài 4:
Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
Giải:
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
- Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH
Bài 5:
Cho 15,5 gam natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
- Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
- Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Giải:
- Phương trình hóa học:
Na2O+H2O→2NaOH
Ta có:
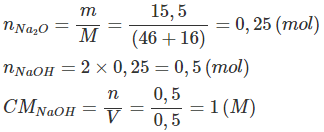
- Phương trình hóa học:
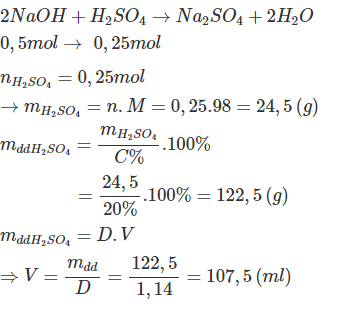
- Bài tập:
Bài 1:
Dùng dung dịch Ca(OH)2, làm thế nào để nhận biết được 3 loại phân bón: KCl, NH4NO3, Ca(H2PO4)2.
Bài 2:
Có những bazơ sau: Mg(OH)2, KOH, Ba(OH)2. Hãy cho biết những bazơ nào
-
- Tác dụng được với với dung dịch HCl.
- Bị nhiệt phân hủy.
- Tác dụng được CO2.
- Đổi màu quỳ tím. thành xanh.
Bài 3:
Hoàn thành các phương trình phản ứng sau:
- ..…. ->Fe2O3 +3H2O
- H2SO4 +…... ->MgSO4 + 2H2O
- NaOH +……-> NaCl + H2O
- …… + CO2 -> Na2CO3 +H2O
- CuSO4 + ……-> Cu(OH)2 + 2H2O
Bài 4:
Viết phương trình phản ứng hóa học của nước với:
- Lưu huỳnh trioxit
- Cacbon đioxit
- Điphotpho pentaoxit
- Canxi oxit
- Natri oxit
Bài 5:
Viết phương trình phản ứng hóa học của KOH tác dụng với:
- Silic oxit
- Lưu huỳnh trioxit
- Cacbon đioxit
- Điphotpho pentaoxit
Bài 6:
Hãy nhận biết các dung dịch sau: H2SO4, NaOH, HCl
Bài 7:
Viết phương trình điều chế xút từ vôi sống và sôđa.
Bài 8:
Cho 18,8 gam natri oxit K2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
- Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
- Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Bài 9:
Dung dịch X chứa 6,2g Na2O và 193,8g nước. Cho X vào 200g dung dịch CuSO4 16% thu được a gam kết tủa .
- Tính nồng độ phần trăm của X.
- Tính a.
- Tính lượng dung dịch HCl 2M cần dùng để hòa tan hết a gam kết tủa sau khi đã nung thành chất rắn đen.
Bài 10:
Trung hòa 300ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
- Tính khối lượng dung dịch NaOH cần dùng.
- Nếu thay dung dịch NaOH bằng dung dịch KOH 5,6% (D = 1,045g/ml) thì lượng KOH cần dùng là bao nhiêu?
- Đáp án:
Bài 1:
Cho 3 loại phân bón vào 3 ống nghiệm chứa dung dịch Ca(OH)2 được đun nóng nhẹ
- Ống nghiệm có khí mùi khai bay ra là NH4NO3:
Ca(OH)2 + 2NH4NO3 -> Ca(NO3)2 + 2NH3 +H2O
- Ống nghiệm có kết tủa trắng là Ca(H2PO4)2
Ca(OH)2 + Ca(H2PO4)2 -> Ca3(PO4)3 + 4H2O
- Ống không có hiện tượng gì là KCl
Bài 2:
- Tất cả các bazơ đều tác dụng với axit HCl:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
KOH + HCl → KaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
- Chỉ có Mg(OH)2 là bazơ không tan nên bị nhiệt phân hủy:
Mg(OH)2 MgO + H2O
- Những bazơ tác dụng với CO2 là KOH và Ba(OH)2.
KOH + CO2 → K2CO3 + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
- Những bazơ đổi màu quỳ tím thành màu xanh là KOH và Ba(OH)2.
Bài 3:
- Fe(OH)3 -> Fe2O3 +3H2O
- H2SO4 + Mg(OH)2-> MgSO4 + 2H2O
- NaOH +HCl -> NaCl + H2O
- 2NaOH + CO2 -> Na2CO3 +H2O
- CuSO4 + 2KOH -> Cu(OH)2 + 2H2O
Bài 4:
- SO3 + H2O -> H2SO4
- CO2 + H2O -> H2CO3
- P2O5 + 3H2O -> 2H3PO4
- CaO + H2O -> Ca(OH)2
- Na2O + H2O -> 2NaOH
Bài 5:
- 2KOH + SiO2 -> K2SiO3 + H2O
- 2KOH + SO3 -> K2SO4 + H2O
- 2KOH + CO2 -> K2CO3 + H2O
- 6KOH + P2O5 -> 2K3PO4 + 3H2O
Bài 6:
Dùng quỳ tím:
- NaOH làm quỳ chuyển màu xanh
- H2SO4, HCl làm quỳ chuyển màu đỏ
Dùng BaCl2 nhận 2 dung dịch axit:
- Có kết tủa trắng là H2SO4
H2SO4 + BaCl2 -> BaSO4 +2HCl
- Không có hiện tượng gì là HCl
Bài 7:
- CaO + H2O -> Ca(OH)2
- Ca(OH)2 + Na2CO3 -> CaCO3 + 2NaOH.
Bài 8:
Số mol K2O = 0,2 mol
- Khi cho K2O xảy ra phản ứng, tạo thành phản ứng dung dịch có chất tan là NaOH.
K2O + H2O → 2KOH
0,2 → 0,4 (mol)
CM, NaOH = 0,4/0,5 = 0,8M.
- Phương trình phản ứng trung hòa dung dịch:
2KOH + H2SO4 → K2SO4 + 2H2O
0,4 → 0,2 0,4 (mol)
mH2SO4 = 0,25×98 = 24,5 g
mH2SO4 = 98g
Vdd = 85,96 ml
Bài 9:
Số mol Na2O = 0,1 mol.
nCuSO4 = 200.16100.160 = 0,2 mol
Na2O + H2O -> 2NaOH
0,1 mol 0,2 mol
Nồng độ % X (tức dung dịch NaOH) :
C% = 0,2.40.1006,2+193,8 = 4%
2NaOH + CuSO4 -> Cu(OH)2 + Na2SO4
0,2 mol 0,1 mol 0,1 mol
a = 0,1. 98 = 9,8g
Cu(OH)2 -> CuO + H2O
0,1 mol 0,1 mol
2HCl + CuO -> CuCl2 + H2O
0,2 mol 0,1mol
Thể tích dung dịch HCl 2M : Vdd = n.V = 0,22 = 0,1 lít
Bài 10:
- Phương trình hóa học: H2SO4 + 2NaOH -> Na2SO4 + 2H2O
Số mol H2SO4 là: nH2SO4 = 0,3 . 1,5 = 0,45 mol
Khối lượng NaOH cần dùng: mNaOH = 2. 0,45. 40 = 36g.
Khối lượng dung dịch NaOH 40%: mdd = 36.10040 = 90g
- Phương trình phản ứng: H2SO4 + 2KOH -> K2SO4 + 2 H2O
Khối lượng KOH cần dùng: mKOH = 2 . 0,45 . 56 = 50,4g
Khối lượng dung dịch KOH: mdd = 50,4.1005,6 = 900g
Thể tích dung dịch KOH cần dùng: Vdd = mdd = 9001,045 = 861,2 ml
CHÚC CÁC BẠN HỌC TỐT <3 NHỚ CHIA SẺ CHO BẠN BÈ CÙNG HỌC NHÉ







