A. PHẦN HỮU CƠ
I. Các khái niệm cần nhớ - Đồng phân, danh pháp
II. Tính chất vật lí : Trạng thái, so sánh nhiệt độ sôi, tính tan và ứng dụng
III. Tính chất hóa học ( giới hạn trong chương trình lớp 12)
1. Những chất phản ứng với Na (K) giải phóng H2 là: Ancol, phenol, axit , H2O
2.Những chất phản ứng dung dịch NaOH (KOH) là: phenol, axit , muối amoni, aminoaxit
3. Những chất phản ứng với dung dịch NaOH (KOH) khi đun nóng: là este; dẫn xuất
4. Những chất phản ứng với CaCO3, NaHCO3 giải phóng CO2 là: axit RCOOH
5. Những chất phản ứng với dung dịch axit HCl, HBr là : ancol, amin, anilin, aminoaxit, muối amoni RCOONH4, muối của amin RNH3Cl
6. Những chất có phản ứng với dung dịch AgNO3/ dd NH3 :
- Khi đun nóng có kết tủa Ag : (phản ứng tráng bạc ) : các chất có nhóm –CHO : RCHO , HCOOH , HCOOR , HCOONH4, glucozơ, fructozơ, mantozơ .
7. Những chất có phản ứng với Cu(OH)2/NaOH
- Tạo thành muối, nước: là axit
- Tạo thành dung dịch có màu xanh lam: các chất có nhiều nhóm OH kế cận: như etilen glycol ; glixerol , glucozơ; Fructozơ ; Mantozơ ; Saccarozơ.
- Khi đun nóng tạo thành kết tủa có màu đỏ gạch Cu2O là : các chất có nhóm –CHO
8. Những chất có phản ứng dung dịch nước brôm:
- Làm mất màu dung dịch nước brôm: các chất không no có liên kết pi ( = ; ≡ ); andehit RCHO bị oxi hóa bới ddBr2.
- Tạo kết tủa trắng: phenol; anilin.
9. Những chất có phản ứng cộng H2 ( Ni): các chất có liên kết pi: ( =; ≡ ); benzen; nhóm chức andehit RCHO; Nhóm chức Xeton RCOR; tạp chức: glucozơ, fructozơ .
10. Các chất có phản ứng thủy phân : Tinh bột; xenlulozơ; mantozơ; saccarozơ, peptit; protein, este, chất béo
11. Các chất có phản ứng trùng hợp : những chất có liên kết đôi ( C=C) hay vòng không bền
12. Những chất có phản ứng trùng ngưng là : Các chất có nhiều nhóm chức.
13. Polime thiên nhiên: cao su thiên nhiên, tơ tằm, bông, xenlulozo , tinh bột
14. Polime nhân tạo ( bán tổng hợp ): tơ Visco, tơ axetat, xenlulozo trinitrat.
15. Polime tổng hợp ( điều chế từ phản ứng trùng hợp hay trùng ngưng): các polime còn lại : PE, PVC….
16. Polime được điều chế từ phản ứng trùng ngưng: Nilon-6 , Nilon-7, Nilon-6,6, tơ lapsan, nhựa PPF
17. Polime được điều chế từ phản ứng trùng hợp: ( còn lại ) : PE, PVC , Caosubuna , Caosu buna-S ,tơnitron….
18. Tơ có nguồn gốc xenlulozo : sợi bông, tơ Visco, tơ axetat
19. Tơ poliamit : Nilon-6 , Nilon-7 , Nilon-6,6 20. Tripeptit….polipeptit, protein lòng trắng trứng: có phản ứng màu biure ( phản ứng Cu(OH)2 có màu tím.
IV. So sánh lực bazo của các amin ( amin no > NH3 > Amin thơm)
V. Môi trường của dung dịch, PH ( chú ý phenol , anilin , Glixin không làm quỳ tím đổi màu)
- Axit RCOOH: quỳ tím hóa đỏ.
- Amin no : quỳ tím hóa xanh. aminoaxit ( tùy vào số nhóm chức )
- Muối của axit mạnh bazo yếu quỳ hóa đỏ.
- Muối của axit yếu bazo mạnh quỳ hóa xanh.
VI. Nhận biết các chất hữu cơ
- Nếu chỉ dùng 1 hoá chất nhận biết hợp chất hữu cơ thì hóa chất thường sử dụng là:
- Quỳ tím ( nếu thấy có amin, axit… )
- Cu(OH)2 ( Nếu thấy có Glucozo , Glixerol , andehit.. )
- Dung dịch brom ( Nếu thấy có Phenol , anilin, hợp chất không no ..
- Phân biệt giữa Glucozơ và Fructozơ dùng dung dịch brom
- Phân biệt giữa đipeptit và các polipeptit khác dùng Cu(OH)2 ( phản ứng màu biore)- Nhận biết protein (lòng trắng trứng …) : dùng Cu(OH)2 : có màu tím xuất hiện hoặc dùng HNO3 : có màu vàng
VII. Điều chế
- Este ( từ phản ứng este hóa : axit phản ứng với ancol ) chú ý các este đặc biệt : vinylaxetat , phenyl axetat ( điều chế riêng )
- Glucozo( từ tinh bột , xenlulozo, mantozo)
- Ancol etylic ( từ glucozo bằng phương pháp lên men)
- Anlin ( từ nitrobenzen)
- Các polime điều chế từ phản ứng trùng ngưng : ( nilon -6, nilon-7, nilon-6,6 , tơ lapsan nhựa PPF)
- Các polime điều chế từ phản ứng trùng hợp : ( PE , PVC , PVA , cao su buna , tơ nitron ….)
B. PHẦN KIM LOẠI
1. Học thuộc
- Cấu hình electron Na( Z=11) [Ne] 3s1 ; Mg ( Z=12) [Ne] 3s2 ; Al( Z=13) [Ne] 3s2 , 3p1 ; Fe( Z=26) [Ar] 3d6, 4s2 ; Cr( ZZ=24) [Ar] 3d5, 4s1 và suy ra vị trí trong bảng tuần hoàn.
2. Nhớ qui luật biến đổi tính chất trong nhóm A ( từ trên xuống: tính kim loại tăng , bán kính nguyên tử tăng , năng lượng ion hóa giảm , độ âm điện giảm)
Nhớ qui luật biến đổi tính chất trong chu kì ( từ trái sang phải : tính kim loại giảm , bán kính nguyên tử giảm , năng lượng ion hóa tăng, độ âm điện tăng , tính phi kim tăng)
3. Tính chất vật lí chung của kim loại
Tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim. Các tính chất vật lí chung này là do các electron tự do trong kim loại gây ra.
- Kim loại dẻo nhất là : Au
- Kim loại dẫn điện tốt nhất là: Ag
- Kim loại nhẹ nhất là : Li ( D = 0,5 g/cm3)
- Kim loại nặng nhất: Os ( D= 22,6 g/ cm3 )
- Kim loại cứng nhất : Cr ( độ cứng =9/10)
- Kim loại mềm nhất: Cs ( độ cứng = 0,2 )
- Kim loại có nhiệt độ nóng chảy cao nhất là : W ( 34100c) thấp nhất là : Hg (-390c)
4. Nhớ dãy điện hóa của kim loại và áp dụng: ( kiến thức trọng tâm) đặc biệt chú ý cặp Fe3+/Fe2+
- Kim loại trước cặp Fe3+/Fe2+ phản ứng với Fe3+ ví dụ : Cu + 2FeCl3 → CuCl2 + 2FeCl2. Ví dụ Fe + 2FeCl3 → 3FeCl2
5. Tính chất hóa học chung của kim loại : Tính khử: ( dễ bị oxi hóa)
- Kim loại phản ứng với oxi : ( trừ Ag , Pt , Au )
- Kim loại phản ứng với HCl và H2SO4 loãng : ( trừ Pb , Cu , Ag , Hg, Pt , Au )
- Kim loại phản ứng với HNO3 và H2SO4 đặc : ( trừ Pt , Au )
- Kim loại phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội : ( trừ Al, Fe , Cr, Pt , Au )
- Kim loại phản ứng với nước ở đk thường : ( có : nhóm IA , Ca, Sr , Ba )
- Kim loại phản ứng dung dịch kiềm ( NaOH , KOH , Ba(OH)2 ) nhớ nhất : Al , Zn
- Kim loại trước cặp Fe3+/Fe2+ phản ứng với Fe3+ví dụ : Cu + 2FeCl3→CuCl2 + 2FeCl2
6. Điều chế kim loại
- Nguyên tắc : khử ion kim loại trong các hợp chất thành kim loại tự do: Mn+ + ne →M
- Phương pháp : điện phân nóng chảy : dùng điều chế kim loại nhóm IA , IIA , Al điện phân dung dịch muối : dùng điều chế kim loại sau nhôm
- Nhiệt luyện : dùng điều chế các kim loại : ( Zn , Cr , Fe ………)
- Thủy luyện : thường nhất dùng điều chế các kim loại : ( Cu , Ag ………)
7. Sự ăn mòn kim loại
Cần phân biệt giữa 2 loại ăn mòn
- Ăn mòn hóa học ( không làm phát sinh dòng điện )
- Ăn mòn điện hóa ( chú ý gợi ý của đề : có 2 kim loại, hợp kim gang, thép để trong dung dịch chất điện li HCl, dd muối, không khí ẩm …)
- Chú ý kim loại có tính khử mạnh hơn thì đóng vai trò cực âm ( anod) bị ăn mòn. Ở cực âm xãy ra quá trình oxi hóa. Dòng electron di chuyển từ cực âm sang cực dương tạo nên dòng điện )
- Ví dụ hợp kim Zn- Cu để trong dung dịch HCl loãng bị ăn mòn điện hóa ( Zn làm cực âm và bị ăn mòn )
8. Học thuôc hai loại hợp kim của sắt : Gang và thép
- Gang : là hợp kim của sắt và C (% C : 2-5%) và một số các nguyên tố : Si , S, Mn , P
- Nguyên tắc sản suất : Dùng than cốc (CO) khử sắt oxit ở nhiệt độ cao.
- Nguyên liệu : quặng sắt , than cốc , chất chảy (CaCO3 hay SiO2)
- Thép: là hợp kim của sắt và C (% C : 0,01-2%) và một lượng rất nhỏ các nguyên tố : Si , S, Mn , P
- Nguyên tắc sản suất : Oxi hóa C , Si , S, P có trong gang để làm giảm hàm lượng của các nguyên tố này .
- Nguyên liệu : gang trắng , không khí , chất chảy (CaCO3 hay SiO2)
9. Công thức một số chất cần nhớ và ứng dụng
- Chứa Ca, Mg: CaCO3.MgCO3: đolomit ; CaSO4.2H2O thạch cao sống; CaSO4.H2O thạch cao nung CaSO4.thạch cao khan; CaCO3: đá vôi
- Chứa Al : Al2O3.2H2O boxit ; Na3AlF6 : criolit ; K2SO4.Al2(SO4)3.24H2O : phèn chua
- Chứa Fe : Fe2O3 ; hematit ; Fe3O4 ;manhetit ; FeCO3xiderit ; FeS2 pirit
10. Nước cứng nước mềm và các phương pháp làm mềm nước cứng
- Nước cứng là nước chứa nhiềuu ion Ca2+ hay Mg2+
- Nước mềm là nước chứa rất ít hay không chứa ion Ca2+ , Mg2+
- Nguyên tắc làm mềm nước : Làm giảm nồng độ các ion Ca2+ , Mg2+ trong nước cứng bằng cách chuyển các ion này thành các chất không tan .
- Để làm mềm nước cứng tạm thời có thể dùng : đun sôi, ddNaOH, Ca(OH)2 vừa đủ, Na2CO3, Na3PO4- Để làm mềm nước cứng vỉnh cữu hay toàn phần dùng : Na2CO3, hay Na3PO4
11.Thuộc tên Kim loại kiềm
- Nhóm IA : Li, Na, , Rb, Cs, Fr: ( là kim loại nhẹ , mềm , dễ nóng chảy , phản ứng được với H2O tạo dung dịch kiềm , oxit , hidroxit tan trong nước tạo dung dịch kiềm là baz mạnh)
12.Thuộc tên Kim loại kiềm thổ :
- Nhóm IIA : Be, Mg, Ca, Sr, Ba, Ra: ( chú ý Ca , Ba , Sr phản ứng với nước tạo dung dịch kiềm. CaO, BaO, SrO, Ca(OH)2, Ba(OH)2, Sr(OH)2 tan trong nước tạo dung dịch kiềm
13. Phản ứng đặt trưng nhất bài Al là phản ứng với dung dịch kiềm Al + NaOH + H2O →NaAlO2 + 3/2 H2, Al2O3 , Al(OH)3 tan trong dung dịch kiềm và dung dịch axit mạnh
- Cần nhớ phản ứng nhiệt nhôm : ví dụ : 2Al + Fe2O3→ Al2O3 + 2Fe ( ứng dụng để hàn kim loại )2Al + Cr2O3→ Al2O3 + 2Cr ( ứng dụng để sản xuất crom ) Chú ý hiện tượng khi cho từ từ dung dịch NaOH vào dung dịch muối AlCl3 ( có kết tủa trắng , dư NaOH kết tủa tan dần )
14. Sắt
Chú ý:
- Các trường hợp Sắt phản ứng tạo hợp chất sắt (II): sắt phản ứng với HCl, H2SO4 loãng, S, dung dịch muối
- Các trường hợp Sắt phản ứng tạo hợp chất sắt (III): sắt phản ứng với HNO3 dư, H2SO4 đặc nóng dư, Cl2, Br2, dung dịch AgNO3 dư
- Tính chất hóa học của hợp chất Sắt (III) Fe2O3 , FeCl3 ….: là tính oxi hóa
- Hợp chất Sắt (II) FeO, FeCl2: có thể là chất khử hay oxi hóa ( tùy phản ứng )- Các oxit sắt , hidroxit sắt là bazơ.
15. Crom
Chú ý
- Các trường hợp Crom phản ứng tạo hợp chất crom (II) : crom phản ứng với HCl, H2SO4 loãng
- Các trường hợp crom phản ứng tạo hợp chất crom (III) : crom phản ứng với HNO3 dư, H2SO4đặc nóng dư, Cl2, Br2, O2, S
- Tính chất hóa học của hợp chất crom (IV) CrO3, K2Cr2O7 ….: là tính oxi hóa
- Hợp chất Crom (III) Cr2O3, CrCl3: có thể là chất khử hay oxi hóa ( tùy phản ứng )
- Các oxit CrO, hidroxit Cr(OH)2 là bazơ.
- Các oxit Cr2O3, hidroxit Cr(OH)3 lưỡng tính
- CrO3, H2CrO4, H2Cr2O7: là axit
16. Các chất lưỡng tính cần nhớ
- Aminoaxit , RCOONH4 , muối HCO3_ , Al2O3, ZnO, BeO, Cr2O3, Al(OH)3, Zn(OH)2, Be(OH)2, Cr(OH)3.
17. Biết phân biệt các chất vô cơ và các hiện tượng xảy ra trong thí nghiệm.
18. Đọc sơ bài hóa học và môi trường liên hệ các kiến thức trong đời sống.
19. Ghi nhớ điều kiện phản ứng trao đổi ion trong dung dịch (sản phẩm có : kết tủa, hay chất khí, hay chất điện li yếu ).
C. MỘT SỐ THÍ NGHIỆM QUAN TRỌNG
1.Thí nghiệm điều chế khí Clo
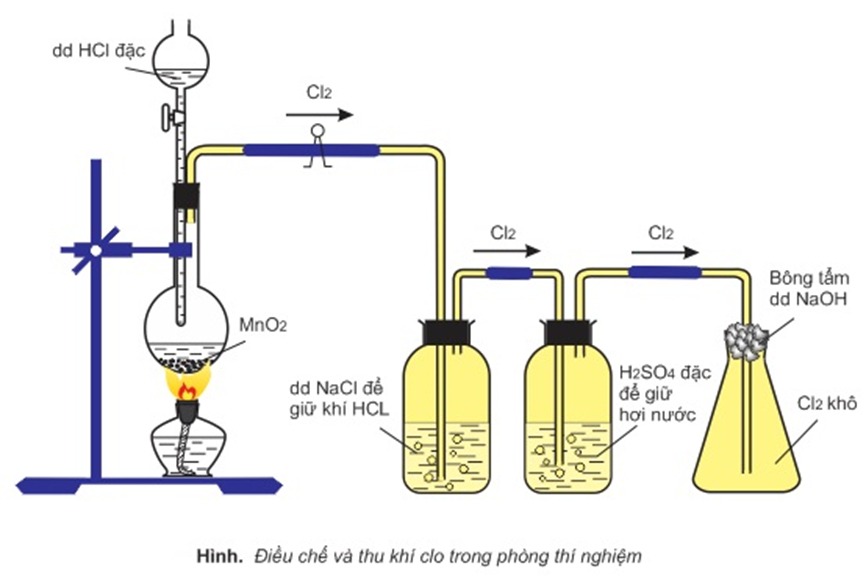
2.Thí nghiệm điều chế axit nitric

3.Thí nghiệm điều chế axetilen


4.Thí nghiệm điều chế khí oxi

5.Thí nghiệm điều chế este

6. Thí nghiệm điều chế khí cacbonic

7.Thí nghiệm hidrosunfua cháy trong điều kiện thiếu không khí

8.Thí nghiệm sự phân hủy amoni clorua

9.Thí nghiệm thử tính tan của amoniac trong nước
10. Thí nghiệm của etien với clo
11. Thí nghiệm chứng minh C,H có trong hợp chất hữu cơ

C.21 KỸ THUẬT ĐỂ GIẢI "SIÊU NHANH" BÀI TẬP HÓA HỌC
1. Sục CO2 (biết mol) vào dung dịch OH– (NaOH, KOH) (biết mol), tìm muối:
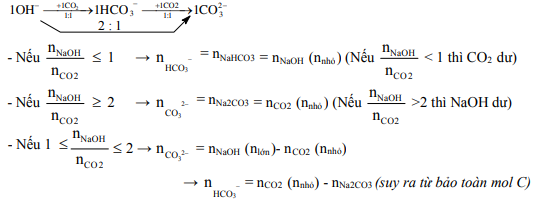
* Lưu ý:
- Có thể thay CO2 bằng SO2 , H2S; NaOH bằngKOH.
- Nếu đề cho mol CO2 và mol muối, hỏi mol NaOH hoặc cho mol NaOH và mol muối, hỏi mol mol CO2 (bài toán ngược) thì ta có thể dùng bảo toàn mol Na, C để giải
2. Sục CO2 (biết mol) vào dung dịch Ca(OH)2 (biết mol), tìm kết tủa:
* Lưu ý:
- Có thể thay Ca(OH)2 bằng Ba(OH)2 .
- Bài toán ngược: ta có thể dùng bảo toàn mol Ca, C để giải
3. Sục CO2 vào dung dịch Ca(OH)2 (biết mol), thu được kết tủa (biết mol). Tìm CO2 .
Bài này thường có 2 đáp số:
4.Sục CO2 vào dung dịch Ca(OH)2, thu được kết tủa (biết mol), đun kĩ dung dịch sau phản ứng thu được kết tủa nữa (biết mol). Tìm CO2.

5. Sục CO2 (biết mol) vào dung dịch hỗn hợp Ca(OH)2 (biết mol) và NaOH (biết mol). Tìm kết tủa
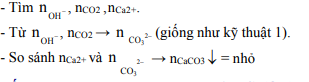
6. Hấp thụ hoàn toàn CO2 vào dung dịch Ca(OH)2 hoặc Ba(OH)2, biết m kết tủa và m dd giảm hoặc mdd tăng. Khi đó:
7.Hấp thụ hoàn toàn hỗn hợp CO2 và H2O vào dung dịch Ca(OH)2 hoặc Ba(OH)2 , biết m kết tủa và m dd giảm hoặc m dd tăng. Khi đó:
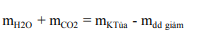
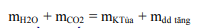
8. Cho dung dịch kiềm (biết mol OH– ) vào dung dịch muối Zn2+ (biết mol), tìm kết tủa Zn(OH)2 và 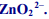
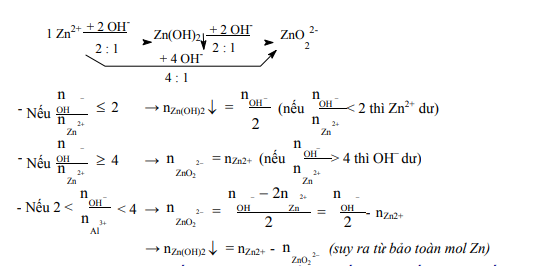
9. Bài toán cho OH– (chưa biết) tác dụng với Zn2+ (đã biết) tạo ra kết tủa (đã biết), yêu cầu tính OH– . Thì bài này thường có 2 đáp số: 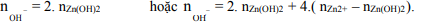
10. Cho dung dịch kiềm (biết mol OH– ) vào dung dịch muối Al3+ (biết mol), tìm kết tủa Al(OH)3 và AlO2-
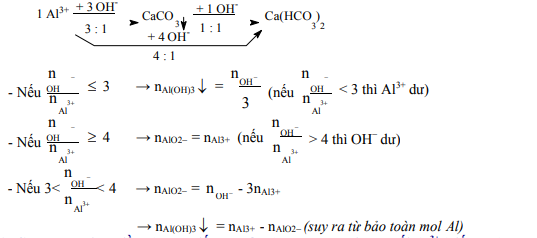
11. Cho dung dịch kiềm (chưa biết mol OH– ) vào dung dịch muối Al3+ (biết mol), thu được kết tủa (biết mol). Tìm OH– .
Bài này thường có 2 đáp số: 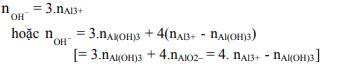
12. Bài toán H3 PO4 tác dụng với dung dịch NaOH (KOH, NH3):

* Lưu ý: Nếu đề cho P2 O5 thì nH3PO4 =2nP2O5
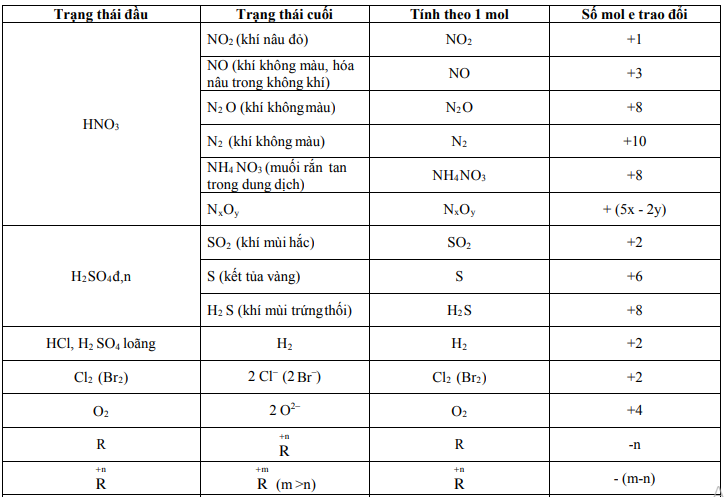
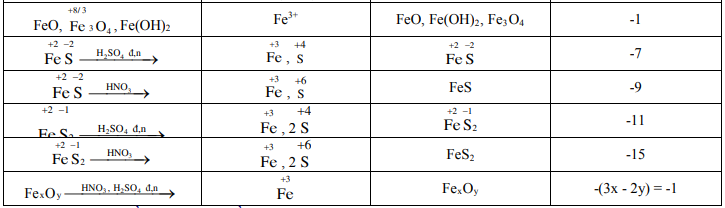
13. Khi cân bằng phản ứng oxihoá – khử hoặc dùng phương pháp bảo toàn mol electron, cần nhớ:
14. Khi giải bài toán về hiđrocacbon, cần nhớ:
a. Khi nung X (gồm 1 hoặc nhiều ankan), sẽ xảy ra phản ứng tách (tách H2, crackinh) thu được hỗn hợp Y, khi đó:
.png)
b. Khi nung X (gồm 1 hoặc nhiều hiđrocacbon không no với H2 ), sẽ xảy ra phản ứng cộng H2 thu được hỗn hợp Y, khi đó:
.png)
15. Khi giải bài toán đốt X (là một hiđrocacbon hoặc hỗn hợp gồm nhiều chất chứa C, H, O đều mạch hở, cùng dãy đồng đẳng), cần nhớ:
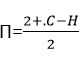
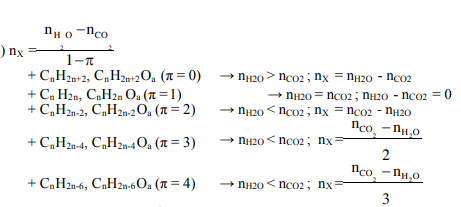
16. Khi giải bài toán ancol, cần nhớ:
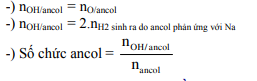
17. Khi giải bài toán andehit, cần nhớ:
-) Khi khử bằng H2, mỗi nhóm chức –CHO nhận 2 electron.
-) Khi oxihoá không hoàn toàn andehit, mỗi nhóm chức -CH=O nhường 2 e, riêng H-CH=O nhường 4e.
-) Khi tráng bạc andehit, mỗi nhóm chức -CH=O tạo 2 Ag, riêng H-CH=O tạo 4Ag
18. Khi giải bài toán axit cacboxylic, cần nhớ:
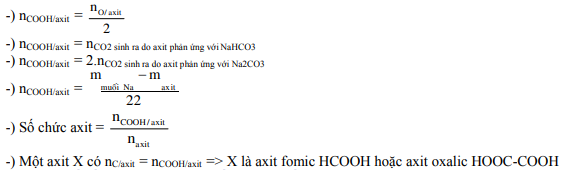
19. Khi tính số đồng phân của các chất hữu cơ, cần nhớ:
- Tính số đồng phân cấu tạo, công thức cấu tạo => không tính số đồng phân hình học.
- Tính số đồng phân, tính số chất => tính cả số đồng phân cấu tạo và đồng phân hình học.
- Số đồng phân của một số gốc hiđrocacbon mạch hở:
- Khi thủy phân este X tạo dung dịch có khả năng tham gia phản ứng tráng bạc → X phải là este của axit fomic H-COO-R hoặc công thức cấu tạo có dạng
- Khi thủy phân este X tạo 2 chất đều có khả năng tham gia phản ứng tráng bạc → công thức cấu tạo của X phải có dạng
20. Khi giải bài toán este, cần nhớ:
-) Thường thì: ; ngoại lệ:
Ví dụ: Este đơn chức X tác dụng với NaOH theo tỉ lệ mol 
-) Với các este không phải là este của phenol:
21. Khi giải bài tập sắp xếp bán kính nguyên tử, tính kim loại (tính khử), tính phi kim (tính oxi hoá ), độ âm điện,cần nhớ:
- Các quy luật biến đổi trong 1 nhóm A từ trên xuống và trong 1 chu kì từ trái qua là trái ngược nhau.
- Nhóm A từ trên xuống bán kính nguyên tử của các nguyên tố tăng dần (do số lớp electron tăng dần).
- Quy luật về bán kính nguyên tử và tính kim loại biến đổi giống nhau.
- Quy luật về tính phi kim, độ âm điện biến đổi ngược chiều với bán kính nguyên tử và tính kim loại.
- Ta có thể dùng tính kim loại và tính phi kim (qua dãy điện hóa, qua nhóm A) làm chuẩn để so sánh các đại lượng kia.









