Phương pháp bảo toàn electron
I. Nguyên tắc của phương pháp bảo toàn e
Khi có nhiều chất oxi hoá hoặc chất khử trong hỗn hợp phản ứng (nhiều phản ứng hoặc phản ứng qua nhiều giai đoạn ) thì "Tổng số mol e mà các chất khử cho phải bằng tổng số mol e mà các chất oxi hoá nhận " Tức là :
n e nhường = n e nhận
II. Các giải pháp để tổ chức thực hiện.
Mấu chốt quan trọng nhất là học sinh phải nhận định đúng trạng thái đầu và trạng thái cuối của các chất o xi hoá ,chất khử ,nhiều khi không cần quan tâm tới cân bằng phản ứng
Phương pháp này đặc biệt lý thú đối với các bài toán phải biện luận nhiều trường hợp xảy ra
III.Các ví dụ
1- Ví dụ 1: Hoà tan hoàn toàn 1.2 gam Kim loại M vào dung dịch HNO3 dư thu được 0.224 lít khí N2 duy nhất ở đktc . Kim loại M là :
A- Mg B- Fe C- Al D- Cu
Hướng dẫn : Chọn đáp án A
Số mol của N2 = 0.01 . Theo bảo toàn e có
M- n(e) → Mn+ 2N+5 + 10 (e) → N2
0.1/n 0.1 0.1 0.01
Suy ra \[\frac{0.1}{n}=\frac{1.2}{M}\] \[\Rightarrow \] M = 12n Lập bảng \[\Rightarrow \] M= 24 ( Mg)
2- Ví dụ 2
Cho 40.5 gam Al tác dụng với dung dịch HNO3 thu được 10.08 lít khí X ở đktc ( không có sản phẩm khử nào khác ) . X là
A.NO2 B.NO C. N2O D. N2
Hướng dẫn : Chọn đáp án D
Số mol của Al = 1.5 ( mol) và số mol khí X = 0.45 mol . Theo bảo toàn e có
Al- 3(e) → Al3+ N+5 + n (e) → sản phẩm
1.5 4.5 0.45n 0.45
Suy ra 0.45 n = 4.5 ⇒ n = 10 . Vậy khí X là N2
3- Ví dụ 3 Cho 8,3 gam hỗn hợp gồm Al,Fe vào 1 lít dung dịch AgNO3 0.1 M và Cu(NO3)2 0.2 M .Sau khi phản ứng kết thúc thu được chất rắn Z ( không tác dụng với dung dịch HCl ) và dung dịch T không còn màu xanh . Khối lưọng của Z và %mAl trong X là :
A. 23.6 gam & 32.53% B. 2.36 gam & 32.53%
C. 23.6 gam & 45.53% D . 12.2 gam & 28.27%
Hướng dẫn : Chọn đáp án A
Z không tác dụng với với dung dịch HCl \[\Rightarrow \] Al, Fe hết
Dung dịch T không còn màu xanh \[\Rightarrow \] Cu(NO3)2 phản ứng hết
Vậy chất rắn Z gồm có Ag,Cu \[\Rightarrow \] mZ = mAg + mCu = 0.1x108 + 0.2 x 64 = 23.6 gam
Gọi số mol của Al ,Fe lần lượt là a,b
Al -3(e) →Al3+ Ag+ + 1(e) →Ag
a 3a 0.1 0.1
Fe - 2(e) →Fe2+ Cu2+ + 2(e) →Cu
b 2b 0.2 0.4
Theo Bảo toàn e ta có phương trình 3a + 2b =0.5
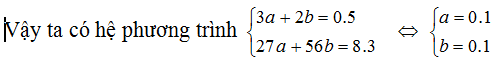
%mAl = \[\frac{0.1x27}{8.3}.100\]=32.53%
4- Ví dụ 4
Hoà tan hỗn hợp X gồm Al và Fe vào dd HNO3 dư sau phản ứng hoàn toàn thu được dd A và 4.4 gam hh khí Y có thể tích 2.688 lít (đktc) gồm 2 khí không màu trong đó có một khí tự hoá nâu ngoài không khí .Số e mà hh X nhường là :
A. 2,53 .1023 B .3,97 .1023 C.3,25 .1023 D. 5,53 .1023
Giáo viên gợi ý :
Muốn tìm số e nhường phải tìm được số mol e nhường vì khi đó 1 mol bao giờ cũng có 6.023 .1023 e ,nên học sinh sẽ nghĩ ngay ra phương pháp sử dụng bảo toàn e
Cách giải : Số mol khí Y là 2.688 : 22.4 = 0.12 mol
Suy ra Mtb= \[\frac{4.44}{0.12}\] = 37 mà có khí NO (M = 30) → khí còn lại là N2O
Gọi số mol NO , N2O lần lượt là a , b
.png)
Khi cho Al,Fe vào dd HNO3 thì
Quá trình oxi hoá Quá trình khử
Al - 3 e → Al3+ N+5 + 3e →N+2
Fe- 3 e → Fe3+ 3a a
2N+5 + 8e →N2+1
8a a
\[\sum \]n e nhường \[\sum \]n e nhận = 11 a = 0.66 mol
Theo định luật bảo toàn e : \[\sum \]n e nhường = \[\sum \]n e nhận = 0.66 mol
⇒ Số e mà hh X nhường là : 0,66 x6.023 . 1023 = 3,97 .1023 Đáp án B
5- Ví dụ 5
Hỗn hợp X gồm FeS2 và MS có số mol bằng nhau ,M là kim loại hoá trị không đổi .Cho 6.51g X tác dụng hoàn toàn với dd HNO3 dư được dd A và 13.216 lít khí ở đktc hỗn hợp khí B gồm NO2 và NO có khối lượng 26.34 gam .Thêm một lượng dư dd BaCl2 vào ddA thấy tạo ra m gam kết tủa .Kim loại M và khối lượng m là :
A- Zn và 20.97g B. Al và 15.57g C. Mg và 4.55 g D. Cu và 45.69g
Hướng dẫn
nkhí B = 13.216 :22.4 = 0.5875 mol .Gọi số mol NO2 và NO là a,b
.png)
dd A + BaCl2 tạo ra kết tủa \[\Rightarrow \] dd A có SO42-
pt Ba2+ + SO42- = BaSO4 \[\downarrow \]
Gọi x là số mol của FeS2 và MS
Quá trình oxi hoá Quá trình khử
FeS2 - 15 e \[\to \] Fe3+ + 2S+6 N+5 + 3e \[\to \]N+2
x \[\to \] 15x 3a a
MS - 8 e \[\to \] M2+ + 2S+6 N+5 + e \[\to \]N+4 x \[\to \] 8x b b
\[\sum \]n e nhường = 15x+8x \[\sum \]n e nhận = 3a+b = 0.69 mol
Theo định luật bảo toàn e : \[\sum \]n e nhường = \[\sum \]n e nhận \[\Rightarrow \] 23 x =0.69 \[\Rightarrow \] x = 0.03
Mặt khác 120.0,03 + (M+32) .0,03 = 6.51 ⇒ M = 65 (Zn)
số mol SO42- = nZnS + 2nFeS2 = 0.03 + 2.0,03 = 0.09
⇒ m = 0.09 x 233 = 20.97 gam Đáp án A
6- Ví dụ 6
Nung 8.4 gam Fe trong không khí sau pư thu được m gam chất rắn X gồm Fe ,Fe2O3 ,FeO , Fe3O4 . Hoà tan hết m gam chất rắn X vào dd HNO3 dư được 2.24 lít khí NO2 ở đktc là sản phẩm khử duy nhất .Giá trị của m là :
A- 11.2 gam B- 10.2 gam C-7.2 gam D- 6.9 gam
Hướng dẫn
8.4 gam Fe \[\xrightarrow{{{O}_{2}}}\]m gam X :FeO ,Fe2O3 ,FeO , Fe3O4 \[\xrightarrow{HN{{O}_{3}}}\]muối Fe3+
Từ trên ta thấy Fe ban đầu đã chuyển hết vào dd dưới dạng muối Fe3+
mO = m - 8.4 \[\Rightarrow \] nO = \[\frac{m-8.4}{16}\]
.png)
\[\sum \]n e nhường = 0.45 \[\sum \]n e nhận = \[\frac{m-8.4}{8}\] + 0.1mol
Theo định luật bảo toàn e : \[\sum \]n e nhường = \[\sum \]n e nhận
\[\Rightarrow \] \[\frac{m-8.4}{8}\] + 0.1 =0.45 \[\Rightarrow \] m = 11.2 gam Đáp án A
7- Ví dụ 7
Để m gam phoi sắt A trong không khí sau pư thu được 12.0 gam chất rắn B gồm FeO ,Fe2O3 ,Fe , Fe3O4 . Cho B tác dụng hoàn toàn với dd HNO3 dư được 2.24 lít khí NO ở đktc là sản phẩm khử duy nhất .Giá trị của m là :
A- 11.2 gam B- 10.08 gam C-11.08 gam D- 1.12 gam
Hướng dẫn
m gam Fe \[\xrightarrow{{{O}_{2}}}\] 12 gam X :FeO,Fe2O3 ,FeO , Fe3O4 \[\xrightarrow{HN{{O}_{3}}}\]muối Fe3+
Từ trên ta thấy Fe ban đầu đã chuyển hết vào dd dưới dạng muối Fe3+
mO =12 - m \[\Rightarrow \] nO = \[\frac{12-m}{16}\]
nFe = m/56
.png)
\[\sum \]n e nhường = \[\frac{3m}{56}\] \[\sum \]n e nhận = \[\frac{12-m}{8}\] + 0.3 mol
Theo định luật bảo toàn e :  n e nhường =
n e nhường =  n e nhận
n e nhận
\[\Rightarrow \]\[\frac{12-m}{8}\] + 0.3 = \[\frac{3m}{56}\]\[\Rightarrow \] m = 10.08 gam Đáp án B
Ví dụ 8 : Cho 13,92 gam Fe3O4 tác dụng hoàn toàn với dung dịch HNO3 sau phản ứng thu được dung dịch X và 0,448 lít khí NxOy (Sản phẩm khử duy nhất ở (đktc). Khối lượng HNO3 nguyên chất đã tham ra phản ứng là
A. 35,28 gam. B. 33,48 gam. C. 12,6 gam. D. 17,64 gam.
Giải:
.png)
- IV.BÀI TẬP TỰ LUYỆN
Câu 1: Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm
0,015 mol khí N2O và 0,01mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là
A. 13,5 gam B. 1,35 gam. C. 0,81 gam. D. 8,1 gam. Câu 2: Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có khối lượng là 15,2 gam. Giá trị của m là
A. 25,6 B. 16. C. 2,56. D. 8.
Câu 3: Một hỗn hợp gồm 4 kim loại : Mg, Ni, Zn và Al được chia thành hai phần bằng nhau :
-
- Phần 1 : cho tác dụng với HCl dư thu được 3,36 lít H2
- Phần 2 : hoà tan hết trong HNO3 loãng dư thu được V lít một khí không màu, hoá nâu trong không khí (các thể tích khí đều do ở đktc). Giá trị của V là
A. 2,24 lít. B. 3,36 lít. C. 4,48 lít. D. 5,6 lít. Câu 4: Cho 3,35 gam hỗn hợp gồm Mg, Al, Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng, dư được 2,8 lít khí SO2 (đktc). Khi đốt 3,35 gam hỗn hợp trên trong khí Clo dư thì khối lượng muối clorua thu được là
A. 10,225 gam. B. 12,225 gam C. 8,125 gam. D. 9,255 gam
Câu 5: Hoà tan hoàn toàn 12,9 gam hỗn hợp Cu, Zn vào dung dịch H2SO4 đặc, nóng được 0,14 mol SO2; 0,64 gam S và dung dịch muối sunfat. % khối lượng Cu trong hỗn hợp ban đầu là
A. 50,39% B. 54,46% C. 50,15% D. 49,61%
Câu 6: Cho 1,35 gam hỗn hợp Cu, Mg, Al tác dụng với HNO3 dư được 896ml hỗn hợp gồm NO
và NO2 có M =42 . Tính tổng khối lượng muối nitrat sinh ra (khí ở đktc).
A. 9,41 gam. B. 10,08 gam. C. 5,07 gam. D. 8,15 gam.
Câu 7: Hoà tan hết 4,43 gam hỗn hợp Al và Mg trong HNO3 loãng thu được dung dịch X (không chứa muối amoni) và 1,568 lít (đktc) hỗn hợp hai khí (đều không màu) có khối lượng 2,59 gam trong đó có một khí bị hoá thành màu nâu trong không khí. Số mol HNO3 đã phản ứng là
A. 0,51. B. 0,45. C. 0,55. D. 0,49.
Câu 8: Hoà tan hoàn toàn m gam Mg hợp gồm ba kim loại (có hóa trị không đổi) bằng dung dịch HNO3 thu được 1,12 lít hỗn hợp khí X (đktc) gồm NO2 và NO. Tỉ khối hơi của X so với hiđro bằng 18,2. Thể tích tối thiểu dung dịch HNO3 37,8% (d =1,242g/ml) cần dùng là
A. 20,18ml. B. 11,12ml. C. 21,47ml. D. 36,7ml.
Câu 9: Hoà tan 6,25 gam hỗn hợp Zn và Al vào 275ml dung dịch HNO3 thu được dung dịch X (không chứa muối amoni), chất rắn Y gồm các kim loại chưa tan hết cân nặng 2,516 gam và 1,12 lít hỗn hợp khí Z (ở đktc) gồm NO và NO2. Tỉ khối của hỗn hợp Z so với H2 là 16,75. Tính nồng độ mol/l của HNO3 và tính khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng.
A. 0,65M và 11,794 gam. B. 0,65M và 12,35 gam.
C. 0,75M và 1l,794 gam. D. 0,55M và 12,35 gam.
Câu 10: Hoà tan hoàn toàn hỗn hợp 9,75 gam Zn và 2,7 gam Al vào 200ml dung dịch chứa đồng thời HNO3 2,5M và H2SO4 0,75M thì thu được khí NO (sản phẩm khử duy nhất) và dung dịch X chỉ gồm các muối. Cô cạn dung dịch X thu được khối lượng muối khan là
A. 57,85 gam. B. 52,65 gam. C. 45,45 gam. D. 41,25 gam.
Câu 11: Cho a gam nhôm tác dụng với b gam Fe2O3 thu được hỗn hợp X. Hoà tan X trong HNO3 dư, thu được 2,24 lít (đktc) một khí không màu hoá nâu trong không khí. Khối lượng nhôm đã dùng là :
- 2,7 gam B. 5,4 gam C. 4,0 gam D. 1,35 gam Câu 12: Đốt cháy 5,6 gam bột Fe trong bình đựng O2 thu được 7,36 gam hỗn hợp X gồm FeO, Fe2O3 Fe3O4 và Fe. Hoà tan hoàn toàn lượng hỗn hợp X bằng dung dịch HNO3 thu được V lít hỗn hợp khí Y gồm NO và NO2 Tỉ khối của Y so với H2 bằng 19. Thể tích V ở đktc là
A. 672ml. B. 336ml. C. 448ml. D. 896ml.
Câu 13: Cho dòng khi CO đi qua ống sứ chứa 0,12 mol hỗn hợp gồm FeO và Fe2O3 nung nóng, phản ứng tạo ra 0,138 mol CO2. Hỗn hợp chất rắn còn lại trong ống nặng 14,352 gam gồm bốn chất. Hoà tan hết hỗn hợp bốn chất này vào dung dịch HNO3 dư được V lít NO (sản phẩm khử duy nhất). Giá trị của V (đktc) là
Câu 14: Cho m gam hỗn hợp X gồm oxit FeO, CuO,Fe2O3 có số mol bằng nhau tác dụng hoàn toàn với lượng vừa đủ là 250ml dung dịch HNO3 khi đun nóng nhẹ thu được dung dịch Y và 3,136 lít (đktc) hỗn hợp khí Z gồm NO2 và NO có tỉ khối so với hiđro là 20,143. Giá trị của m là.
A. 74,88 B. 52,35. C. 61,79. D. 72,35
Câu 15: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 1,344lít (đktc) NO (là sản phẩm khử duy nhất) là dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị m là
A. 49,09 B. 34,36. C. 35,50. D. 38,72.
Câu 16: Cho 1 luồng khi CO đi qua ống đựng Fe2O3 nung nóng. Sau một thời gian thu được 44,46 gam hỗn hợp X gồm Fe, FeO, Fe2O3 Fe3O4. Cho X tác dụng vừa đủ với dung dịch HNO3 0,1M thì thu được dung dịch Y và 3,136 lít khí NO duy nhất (đktc). Thể tích dung dịch HNO3 đã dùng là
A. 1,94 lít. B. 19,4 lít. C. 15 lít. D. 1,34 lít.
Câu 17: Dung dịch X gồm AgNO3 và Cu(NO3)2 có cùng nồng độ. Lấy một lượng hỗn hợp gồm 0,03 mol Al; 0,05 mol Fe cho vào 100ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y chứa 3 kim loại. Cho Y vào HCl dư giải phóng 0,07 gam khí. Nồng độ của hai muối là
A. 0,3M. B. 0,4M. C. 0,42M. D. 0,45M.
Câu 18 : Có 2 bình điện phân mắc nối tiếp. Bình (1) chứa CuCl2. Bình (2) chứa AgNO3. Khi ở anot của bình (1) thoát ra 22,4 lít một khí duy nhất thì ở anot của bình 2 thoát ra bao nhiêu là khí ?
A. 11,2 lít B. 22,4 lít C. 33,6lít D. 44,8 lít
Câu 19: Hoà tan 1,52 gam hỗn hợp Fe và Cu vào 200ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X, 224ml khí NO (sản phẩm khử duy nhất ở đktc và còn 0,64 gam chất rắn không bị hoà tan. Nồng độ mol của dung dịch HNO3 là
A. 0,1M. B. 0,2M. C. 0,25M. D. 0,5M.
Câu 20: Hỗn hợp X gồm Fe và Cu với tỉ lệ phần trăm khối lượng là 4: 6. Hoà tan m gam X bảng dung dịch HNO3 thu được 0,448 lít khí NO (sản phẩm khử duy nhất ở đktc) dung địch Y và có 0,65m (gam) kim loại không tan. Khối lượng muối khan trong dung dịch X là
A. 5,4 gam. B. 6,4 gam. C. 11,2 gam. D. 8,6 gam.
ĐÁP ÁN
|
1B |
2A |
3A |
4B |
5D |
6C |
7D |
8C |
9A |
10C |
|
11A |
12D |
13C |
14A |
15D |
16B |
17B |
18A |
19B |
20A |







