I. TÓM TẮT LÍ THUYẾT
1. Chuyển đổi giữa lượng chất và khối lượng chất như thế nào?
1.1. Ví dụ
Ví dụ: Em có biết 0,25 mol CO2 có khối lượng là bao nhiêu gam? Biết khối lượng mol của CO2 là 44g/mol
Hướng dẫn:
Khối lượng của 0,25 mol CO2 là: = 0,25 . 44 = 11 (gam)
Ta đã biết: 1 mol phân tử CO2 có khối lượng 44 gam
0,25 mol phân tử CO2 có khối lượng x gam
Từ đó có x = 0,25. 44 = 11 (g); Hay
1.2. Công thức
1 mol nguyên tử (phân tử) có khối lượng là M (gam)
n mol nguyên tử (phân tử) có khối lượng là n . M (gam)
Nhận xét:
Đặt n: số mol chất (mol)
M: là khối lượng mol chất (gam/mol)
m: là khối lượng chất (gam)
Ta lấy số mol chất nhân với khối lượng mol chất đó. Công thức m = n.M (gam) (1)
Từ công thức (1) ta triển khai ra được 2 công thức liên quan như sau:
và
1.3. Kết luận
- Tìm khối lượng chất (m) khi biết số mol chất (n), ta tìm khối lượng mol (M) của chất, sau đó áp dụng công thức: m = n . M (gam)
- Tìm số mol chất (n) khi biết khối lượng chất (m), ta tìm khối lượng mol (M), sau đó áp dụng công thức:
- Tìm khối lượng mol (M) khi biết số mol (n) và khối lượng (m), ta áp dụng công thức:
2. Chuyển đổi giữa lượng chất và thể tích chất khí như thế nào?
2.1. Ví dụ
Ví dụ: Em có biết 0,25 mol CO2 ở điều kiện tiêu chuẩn có thể tích là bao nhiêu lít?
Hướng dẫn:
1 mol khí ở điều kiện tiêu chuẩn chiếm 22,4 lít
0,25 mol ở điều kiện tiêu chuẩn chiếm 0,25.22,4 = 5,6 (lit)
2.2. Công thức
1 mol nguyên tử (phân tử) có thể tích là 22,4 (lit)
n mol nguyên tử (phân tử) có thể tích là 22,4 . n (lit)
Nhận xét:
Đặt n: số mol chất (mol)
V: Thể tích chất ở điều kiện tiêu chuẩn (lit)
Ta lấy số mol chất nhân với 22,4. Công thức V = 22,4 . n (lit) (2)
Từ công thức (2) ta triển khai ra được công thức liên quan:
2.3. Kết luận
- Tìm thể tích chất khí ta sử dụng công thức: V = 22,4 . n (lit)
- Tìm số mol chất khí: \[n=\frac{V}{22,4}\]
II.GIẢI BÀI TẬP SÁCH GIÁO KHOA
Câu 1.(Trang 67 SGK)
Kết luận nào sau đây đúng ?
Nếu hai chất khí khác nhau mà có thể tích bằng nhau (đo cùng nhiệt độ và áp suất) thì:
a) Chúng có cùng số mol chất.
b) Chúng có cùng khối lượng .
c) Chúng có cùng số phân tử.
d) Không thể kết luận được điều gì cả.
Bài làm:
Kết luận đúng là:
a) Chúng có cùng số mol chất.
c) Chúng có cùng số phân tử.
Câu 2.(Trang 67 SGK)
Kết luận nào sau đây đúng ?
Thế tích mol của chất khí phụ thuộc vào:
a) Nhiệt độ của chất khí;
b) Khối lượng mol của chất khí;
c) Bản chất của chất khí;
d) Áp suất của chất khí.
Bài làm:
Kết luận đúng là:
a) Nhiệt độ của chất khí;
d) Áp suất của chất khí.
Câu 3.(Trang 67 SGK)
Hãy tính:
a) Số mol của: 28 g Fe; 64 g Cu; 5,4 g Al
b) Thể tích khí (đktc) của: 0,175 mol CO2; 1,25 mol H2; 3 mol N2
c) Số mol và thể tích của hỗn hợp khí (đktc) gồm có: 0,44 g CO2; 0,04 g H2; 0,56 g N2
Bài làm:
a) Số mol của:
- 28 g Fe: nFe = \[\frac{28}{56}\] = 0,5 mol
- 64 g Cu: nCu =\[\frac{64}{64}\] = 1 mol
- 5,4 g Al: nAl = \[\frac{5,4}{27}\] = 0,2 mol
b) Thể tích khí (đktc) của:
- 0,175 mol CO2: VCO2 = 22,4 . 0,175 = 3,92 lít
- 1,25 mol H2: VH2 = 22,4 . 1,25 = 28 lít
- 3 mol N2: VN2 = 22,4 . 3 = 67,2 lít
c) Số mol của hỗn hợp khí:
- nhh = 0,01 + 0,02 + 0,02 = 0,05 mol
Thể tích của hỗn hợp khí
- Vhh = 0,05 . 22,4 = 1,12 lít
Câu 4.(Trang 67 SGK)
Hãy tính khối lượng của những lượng chất sau:
a) 0,5 mol nguyên tử N; 0,1 mol nguyên tử Cl; 3 mol nguyên tử O.
b) 0,5 mol phân tử N2; 0,1 mol phân tử Cl2; 3 mol phân tử O2
c) 0,10 mol Fe; 2,15 mol Cu; 0,80 mol H2SO4; 0,50 mol CuSO4.
Bài làm:
a) mN = 0,5 . 14 = 7 g;
mCl = 0,1 . 35,5 = 3,55 g;
mO = 3 . 16 = 48 g;
b) mN2 = 28 . 0,5 = 14 g;
mCl2= 71 . 0,1 = 7,1 g;
mO2 = 32 . 3 = 96 g
c) mFe= 56 . 0,1 = 5,6 g;
mCu = 64 . 2,15 = 137,6 g;
mH2SO4 = (2 + 32 + 64) . 0,8 = 78,4 g;
mCuSO4 = (64 + 32 + 64) . 0,5 = 80 g
Câu 5.(Trang 67 SGK)
Cho 100 g khí oxi và 100 g khí cacbon đioxit, cả 2 khí đều ở 200C và 1 atm. Biết rằng thể tích mol khí ở những điều kiện này là 24 l. Nếu trộn 2 khối lượng khí trên với nhau (không có phản ứng xảy ra) thì hỗn hợp khí thu được có thể tích là bao nhiêu ?
Bài làm:
nCO2 = m/M = \[\frac{100}{44}\] = 2,273 (mol)
nO2 = m/M = \[\frac{100}{32}\] = 3,125 (mol)
Thể tích mol khí ở 20oC và 1 atm là 24 lít => Thể tích hỗn hợp khí thu được là;
Vhh = (3,125 + 2,273).24 = 129,552 (lít)
Câu 6.(Trang 67 SGK)
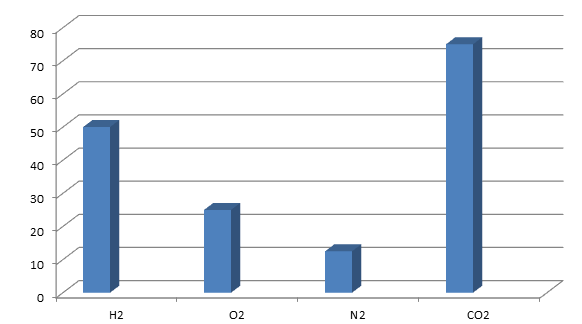
Hãy vẽ những hình khối chữ nhật để so sánh thể tích các khí sau (đktc):
1g H2; 8 g O2; 3,5 g N2; 33 g CO2.
Bài làm:
Số mol của các khí là:
nH2 = \[\frac{1}{2}\] = 0,5 mol
nO2 = \[\frac{8}{32}\] = 0,25 mol
nN2 = \[\frac{3,5}{28}\] = 0,125 mol
nCO2 = \[\frac{33}{44}\] = 0,75 mol
Tỉ lệ số mol chính là tỉ lệ thể tích nên ta có có: