LÝ THUYẾT VỀ NITO
A. LÝ THUYẾT
I. Cấu tạo phân tử và tính chất vật lý
- Cấu tạo phân tử: N2 (N ≡ N), có 1 liên kết ba bền vững
- Chất khí, không màu, không mùi, không vị, không duy trì sự sống, sự cháy.
II. Tính chất hóa học:
Nhận xét:
- Ở nhiệt độ thường, khí N2 trơ về mặt hóa học
- Ở nhiệt độ cao, có chất xúc tác khí N2 hoạt động hóa học mạnh hơn, thể hiện cả tính khử và tính OXH. Tuy nhiên tính OXH vẫn là tính chất đặc trưng
1. Thể hiện tính OXH khi tác dụng với kim loại hoạt động mạnh và khí H2
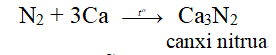
- Các nitrua kim loại dễ dàng thủy phân trong nước tạo ra dung dịch kiềm và giải phóng khí NH3
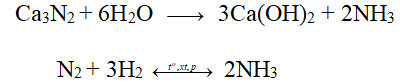
2. Thể hiện tính khử khi tác dụng với O2

III. Điều chế:
1. Phòng thí nghiệm:
- Nhiệt phân NH4NO2 hoặc hỗn hợp ( NH4Cl và NaNO2 )
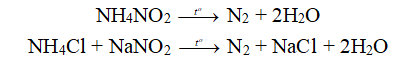
2. Trong công nghiệp:
- Chưng cất phân đoạn không khí lỏng
- Dựa vào nhiệt độ sôi các chất trong không khí là khác nhau
- Thu khí bằng PP đẩy nước
IV. Trạng thái tự nhiên
- Trong tự nhiên, nitơ tồn tại ở dạng tự do và trong hợp chất:
+ Dạng tự do: Nitơ chiếm 80% thể tích không khí.
+ Dạng hợp chất: có nhiều ở dạng NaNO3 (diêm tiêu natri), trong thành phần protein, axit nucleic...
V. Ứng dụng:
- Phần lớn được dùng để tổng hợp amoniac từ đó sản xuất ra các loại phân đạm, axit nitric...
- Dùng làm môi trường trơ cho các ngành công nghiệp luyện kim.
- Nitơ lỏng được dùng để bảo quản máu và các các mẫu sinh học khác.…
B. BÀI TẬP CÓ HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1: Cặp công thức của liti nitrua và nhôm nitrua là
A. LiN3 và Al3N. B. Li2N3 và Al2N3.
C. Li3N và AlN. D. Li3N2 và Al3N2.
Đáp án: C
Hướng dẫn:
Liti nitrua : Li3N
Nhôm nitrua : AlN
Câu 2: Cho 2 phản ứng sau:
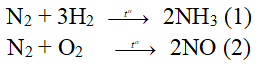
A. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
B. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
C. Cả hai phản ứng đều thu nhiệt.
D. Cả hai phản ứng đều toả nhiệt.
Đáp án: B
Hướng dẫn:
N2 + 3H2 ® 2NH3 (1) DH = -92kJ phản ứng tỏa nhiệt
N2 + O2 ® 2NO (2) DH = +180KJ phản ứng thu nhiệt
Câu 3: Có thể sử dụng chất nào sau đây để nhận biết khí N2 có chứa tạp chất H2S?
A. NaOH. B. Pb (NO3)2. C. NH3. D. Cu.
Đáp án: B
Hướng dẫn:
Cho Pb(NO3)2 vào 2 mẩu thử trên thấy kết tủa màu đen nhận biết được H2S
Pb(NO3)2 + H2S ¾¾® PbS + 2HNO3
Còn lại là N2 không thấy hiện tượng gì
Câu 4: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2 + 3H2 ® 2NH3 .
B. N2 + 6Li ® 2Li3N.
C. N2 + O2 ® 2NO.
D. N2 + 3Mg ® Mg3N2.
Đáp án: C
Hướng dẫn:
- Nito thể hiện tính khử là nhường electron
N2 + O2 ® 2NO
- Nito thể hiện tính oxi hóa là quá trình nhận electron
N2 + 3H2 ® 2NH3,
N2 + 6Li ® 2Li3N,
N2 + 3Mg ® Mg3N2.
Câu 5: Nitơ thể hiện tính oxi hóa khi tác dụng với chất nào sau đây?
A. Mg, H2. B. Mg, O2. C. H2, O2. D. Ca,O2.
Đáp án: A
Hướng dẫn:
Nito thể hiện tính oxi hóa là quá trình nhận electron
N2 + 3H2 ® 2NH3
N2 + 3Mg ® Mg3N2
C. BÀI TẬP TỰ LUYỆN
Câu 1: Để tách riêng khí N2 ra khỏi hỗn hợp gồm N2, SO2, C2H4 chỉ cần dẫn hỗn hợp khí qua dung dịch
A. AgNO3 dư. B. nước brom dư.
C. nước vôi trong dư. D. H2SO4 đặc.
Đáp án: B
Câu 2: Để tách riêng khí N2 ra khỏi hỗn hợp gồm N2, SO2, CO2 chỉ cần dẫn hỗn hợp khí qua dung dịch
A. HCl dư. B. nước brom dư.
C. nước vôi trong dư D. H2SO4 đặc.
Đáp án: C
Câu 3: Trong phòng thí nghiệm người ta thu khí nitơ bằng phương pháp dời nước vì
A. N2 nhẹ hơn không khí.
B. N2 rất ít tan trong nước.
C. N2 không duy trì sự sống, sự cháy.
D. N2 hoá lỏng, hóa rắn ở nhiệt độ rất thấp.
Đáp án: B
Câu 4: Trong phản ứng: 2NO2 + H2O → HNO3 + HNO2.
Khí NO2 đóng vai trò
A. Chất oxi hoá.
B. Chất khử.
C. Vừa là chất oxi hoá, vừa là chất khử.
D. Không là chất oxi hoá và chất khử.
Đáp án: C
Câu 5: Nitơ có nhiều trong khoáng vật diêm tiêu, diêm tiêu có thành phần chính là
A. NaNO2. B. NH4NO3. C. NaNO3. D. NH4NO2.
Đáp án: C







