Câu 1 ( Trích đề thi tuyển sinh ĐH – CĐ khối A- 2009))
Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi xảy ra phản ứng hoàn toàn, thu được khí NO ( sản phẩm khử duy nhất ) và dung dịch X. Dung dịch X có thể hòa tan tối đa m gam Cu. Gía trị của m là :
- 1,92 B. 0,64 C. 3,84 D. 3,20
Câu 2: ( Trích đề thi tuyển sinh ĐH – CĐ khốI A – 2009 )
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2 M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO ( sản phẩm khử duy nhất ). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là :
- 240. B.120. C.360. D.400
Lời giải
Câu 1 : Đáp án A
nFe = 0,12 mol, nHNO3 = 0,4 mol
Vì Fe phản ứng với HNO3 tạo thành sắt III nhưng sau phản ứng với Cu nên coi sắt chỉ lên Fe (II)
3Fe + 8H+ + 2NO3- →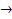 3Fe2+ + 2NO + 4H2O
3Fe2+ + 2NO + 4H2O
0,12 0,32 0,08 mol
3Cu + 8H++ 2NO3-→ 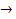 3Cu2+ + 2NO + 4H2O
3Cu2+ + 2NO + 4H2O
0,03 0,08 0,02 mol
mCu = 0,03*64 = 1,92 gam
Câu 2 : Đáp án C
Dễ dàng nhẩm được nFe = 0,02 mol; nCu = 0,03mol , vậy số mol e nhường tối đa là n = 0,12 mol
Thay vào pt ion thu gọn:
4H+ + NO3- + 3e → 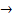 NO + 2H2O
NO + 2H2O
ta dễ dàng nhận thấy H+ và NO3- còn dư, do đó kim loại đã tan hết thành Fe3+ và Cu2+
ta có : nH+ dư = 0,4 ×0,5×2-0,12×43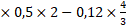 = 0,24 mol = số mol OH- để trung hòa
= 0,24 mol = số mol OH- để trung hòa
Kết tủa thu được là Fe(OH)3 và Cu(OH)2 mà theo Bảo toàn điện tích thì:
Số mol OH- trong kết tủa = số mol điện tích dương của ion kim loại = 0,12 mol
Do đó số n NaOH tối đa để đạt lượng kết tủa lớn nhất là 0,12+ 0,24= 0,36 mol
Vậy V = 360ml







