A. TÓM TẮC KIẾN THỨC:
I. DUNG MÔI – CHẤT TAN – DUNG DỊCH:
Vd 1: Hòa tan đường vào nước
- Nước là dung môi.
- Đường là chất tan.
- Nước đường là dung dịch.
Vd 2: Dầu ăn tan trong xăng tạo thành dd.
* Kết luận:
- Dung môi là chất có khả năng hòa tan chất khác để tạo thành dung dịch.
- Chất tan là chất bị hòa tan trong dung môi.
- Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
II. DUNG DỊCH CHƯA BÃO HÒA. DUNG DỊCH BÃO HÒA:
* Kết luận: Ở một nhiệt độ xác định.
- Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
- Dung dịch bão hòa là dung dịch không thể hòa tan thên chất tan.
- Làm thế nào để quá trình hòa tan chất rắn xảy ra nhanh hơn?
1. Khuấy dung dịch:
2. Đun nóng dung dịch.
3. Nghiền nhỏ chất rắn.
III. ĐỘ TAN CỦA MỘT CHẤT TRONG NƯỚC:
1. Định nghĩa:
Độ tan (kí hiệu là S) của một chất trong nước là số gam chất đó hòa tan trong 100g nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
Công thức tính: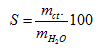 hay
hay .png)
- Độ tan của chất rắn trong nước phụ thuộc vào nhiệt độ. Thường độ tan tăng khi nhiệt độ tăng.
- Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất.
2. Tính tan trong nước của một số axit, bazơ, muối:
- Axit: Hầu hết axit đều tan trong nước, trừ a xit sili xic ( H2SiO3).
- Bazơ: Phần lớn các bazơ không tan trong nước, trừ một số như: KOH, NaOH, Ba(OH)2, còn Ca(OH)2 ít tan.
- Muối:
+ Những muối natri, kali đều tan.
+ Những muối nitrat đều tan.
+ Phần lớn muối clorua, sunfat tan được.
Phần lớn muối cacbonat không tan.
IV. NỒNG ĐỘ DUNG DỊCH:
1. Nồng độ phần trăm của dung dịch (C%):
* Định nghĩa:
Nồng độ phần trăm (kí hiệu là C%) của một dung dịch cho ta biết số gam chất tan có trong 100g dung dịch.
* Công thức tính: .png)
Trong đó: - mct: Khối lượng chất tan(gam).
- mdd: Khối lượng dung dịch(gam).
- mdd = mdm + mct.
* Khối lượng riêng: .png)
.png)
Vậy: .png)
Bài tập 1: Hòa tan 10g đường vào 40g nước. Tính nồng độ phần trăm của dung dịch thu được.
Bài tập 2: Tính khối lượng NaOH có trong 200g dung dịch NaOH 15%.
Bài tập 3: Hòa tan 20g muối vào nước được dung dịch có nồng độ là 10%.
Hãy tính:
a) Tính khối lượng dung dịch nước muối muối thu được.
b) Tính khối lượng nước cần dùng cho sự pha chế.
Bài tập 4: Trộn 50g dung dịch muối ăn có nồng độ 20% với 50g dung dịch muối ăn 5%.
Tính nồng độ phần trăm của dung dịch thu được.
2. Nồng độ mol của dung dịch (CM):
* Định nghĩa:
Nồng độ mol (kí hiệu là CM) của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
* Công thức tính: .png) (mol/ lít)
(mol/ lít)
Trong đó: n: Số mol chất tan (mol).
V: Thể tích dung dịch (lít).
Bài tập 1: 250 ml dung dịch có hòa tan 0,1mol H2SO4. Hãy tính nồng độ mol của dung dịch axit.
Bài tập 2: 400 ml dung dịch có hòa tan 20g NaOH. Hãy tính nồng độ mol của dung dịch bazơ.
Bài tập 3: Tìm số mol chất tan có trong 250 ml dung dịch HCl 0,5M.
Bài tập 4: Tìm khối lượng chất tan có trong 50 ml dung dịch NaCl 0,1M.
Bài tập 5: Tìm thể tích của dung dịch HCl 2M để trong đó có hòa tan 0,5 mol HCl.
Bài tập 6: Tìm thể tích của dung dịch NaOH 5M để trong đó có hòa tan 60g NaOH.
V. PHA CHẾ DUNG DỊCH:
1. Cách pha chế một dung dịch theo nồng độ cho trước:
Bài tập 1: Từ muối CuSO4, nước cất và những dụng cụ cần thiết, hãy tính toán và giới thiệu cách pha chế.
a. 50g dd CuSO4 có nồng độ 10%.
b. 50ml dd CuSO4 có nồng độ 1M.
Bài giải:
a). Tính toán:
- Tìm khối lượng chất tan:
\[{{m}_{CuS{{O}_{4}}}}=\frac{10.50}{100}=5(g).\]
- Tìm khối lượng dung môi (nước):
mdm = mdd - mct = 50 - 5 = 45(g).
- Cách pha chế:
+ Cân lấy 5g CuSO4 rồi cho vào cốc.
+ Cân lấy 45g (hoặc đong 45ml) nước cất, rồi đổ dần vào cốc và khuấy nhẹ.
\[\to \] Thu được 50g dd CuSO4 10%.
b). Tính toán:
- Tìm số mol chất tan:
\[{{n}_{CuS{{O}_{4}}}}=0,05.1=0,05(mol).\]
- Tìm khối lượng của 0,05mol CuSO4.
\[{{m}_{CuS{{O}_{4}}}}=0,05.160=8(g).\]
- Cách pha chế:
+ Cân lấy 8g CuSO4 rồi cho vào cốc.
+ Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 50ml dung dịch.
\[\to \] Thu được 50ml dd CuSO4 1M.
Bài tập 2:Từ muối ăn NaCl, nước cất và những dụng cụ cần thiết, hãy tính toán và giới thiệu cách pha chế. a. 100g dd NaCl có nồng độ 20%.
b. 50ml dd NaCl có nồng độ 2M.
Bài giải:
a). Tính toán:
- Tìm khối lượng chất tan:
\[{{m}_{NaCl}}=\frac{20.100}{100}=20(g).\]
- Tìm khối lượng dung môi (nước):
mdm = mdd - mct = 100- 20 = 80(g).
- Cách pha chế:
+ Cân lấy 20g NaCl rồi cho vào cốc.
+ Đong 80ml nước, rót vào cốc và khuấy đều để muối ăn tan hết.
\[\to \] Thu được 100g dd NaCl 20%.
b). Tính toán:
- Tìm số mol chất tan:
\[{{n}_{NaCl}}=0,05.2=0,1(mol).\]
- Tìm khối lượng của 0,1mol NaCl.
\[\]\[{{m}_{NaCl}}=0,2.58,5=5,85(g).\]
- Cách pha chế:
+ Cân lấy 5,85g NaCl rồi cho vào cốc.
+ Đổ dần dần nước cất vào cốc cho đến vạch 50ml, khuấy nhẹ.
\[\to \] Thu được 50ml dd NaCl 2M.
2. Cách pha loãng một dung dịch theo nồng độ cho trước:
Bài tập: Từ nước cất và những dụng cụ cần thiết, hãy tính toán và giới thiệu cách pha chế.
a. 100ml dd MgSO4 0,4M từ dung dịch MgSO4 2M.
b. 150g dd NaCl 2,5% từ dung dịch NaCl 10%.
Bài giải:
a). Tính toán:
- Tìm số mol chất tan có trong 100ml dd MgSO4 0,4M.
\[{{n}_{MgS{{O}_{4}}}}=0,4.0,1=0,04(mol).\]
- Tìm thể tích dung dịch MgSO4 2M trong đó có chứa 0,04mol MgSO4.
\[V=\frac{0,04}{2}=0,02(l)=20(ml).\]
- Cách pha chế:
+ Đong lấy 20ml dd MgSO42M rồi cho vào cốc chia độ có dung tích 200ml.
+ Thêm từ từ nước cất vào cốc đến vạch 100ml và khuấy đều.
\[\to \] Thu được 100ml dd MgSO4 0,4M.
b). Tính toán:
- Tìm khối lượng NaCl có trong 150g dd NaCl 2,5%:
\[{{m}_{NaCl}}=\frac{2,5.150}{100}=3,75(g).\]
- Tìm khối lượng dd NaCl ban đầu có chứa 3,75g NaCl.
\[{{m}_{dd}}=\frac{3,75.100}{10}=37,5(g).\]
- Tìm khối lượng nước cần dùng để pha chế:
\[{{m}_{{{H}_{2}}O}}=150-37,5=112,5(g).\]
- Cách pha chế:
+ Cân lấy 37,5g dd NaCl 10% ban đầu, sau đó đổ vào cốc nước có dung tích khoảng 200ml.
+ Cân lấy 112,5g nước cất, sau đó đổ vào cốc đựng dung dịch NaCl nói trên, khuấy đều.
\[\to \] Thu được 150g dd NaCl 2,5%.
B. BÀI TẬP ÁP DỤNG:
Câu 1: Hoà tan 450g KNO3 vào 500g nước cất ở 2500C (dung dịch X). Biết độ tan của KNO3 ở 200C là32g. Hãy xác định khối lượng KNO3 tách ra khỏi dung dịch khi làm lạnh dung dịch X đến 200C. ĐS: ${{m}_{\text{KN}{{\text{O}}_{\text{3}}}\ \text{ta}\grave{u}\text{ch ra kho}\hat{u}\text{i dd }}}=290(g)$
Câu 2: Cho 0,2 mol CuO tan hết trong dung dịch H2SO4 20% đun nóng (lượng vừa đủ). Sau đó làm nguội dung dịch đến 100C. Tính khối lượng tinh thể CuSO4.5H2O đã tách khỏi dung dịch, biết rằng độ tan của CuSO4 ở 100C là 17,4g.
ĐS: ${{m}_{\text{CuS}{{\text{O}}_{\text{4}}}\text{.5}{{\text{H}}_{\text{2}}}\text{O }}}=30,7(g)$
Câu 3: Lấy 11,44 (g) Na2CO3.10H2O được hoà tan trong 50,1ml nước cất (D = 1g/ml). Tính nồng độ phần trăm của dung dịch thu được.
Câu 4: Lấy 8,4 (g) MgCO3 hoà tan vào 146 (g) dung dịch HCl thì vừa đủ.
- Viết phương trình phản ứng.
- Tính nồng độ phần trăm của dung dịch HCl đầu?
- Tính nồng độ phần trăm các chất trong dung dịch sau phản ứng?
Câu 5: Hoà tan 10 (g) CaCO3 vào 114,1 (g) dung dịch HCl 8%.
- Viết phương trình phản ứng.
- Tính nồng độ phần trăm các chất thu được sau phản ứng?
Câu 6: Hoà tan hoà toàn 16,25g một kim loại hoá trị (II) bằng dung dịch HCl 18,25% (D = 1,2g/ml), thu được dung dịch muối và 5,6l khí hiđro (đktc).
- Xác định kim loại?
- Xác định khối lượng ddHCl 18,25% đã dùng?
Tính CM của dung dịch HCl trên?
- Tìm nồng độ phần trăm của dung dịch muối sau phản ứng?
Câu 7: Cho a (g) Fe tác dụng vừa đủ 150ml dung dịch HCl (D = 1,2 g/ml) thu được dung dịch và 6,72 lít khí (đktc). Cho toàn bộ lượng dung dịch trên tác dụng với dung dịch AgNO3 dư, thu được b (g) kết tủa.
- Viết các phương trình phản ứng.
- Tìm giá trị a, b?
- Tính nồng độ phần trăm và nồng độ mol/l dung dịch HCl?
Câu 8: Một hỗn hợp gồm Na2SO4 và K2SO4 trộn theo tỉ lệ 1 : 2 về số mol. Hoà tan hỗn hợp vào 102 (g) nước, thu được dung dịch A. Cho 1664 (g) dung dịch BaCl2 10% vào dung dịch A, xuất hiện kết tủa. Lọc bỏ kết tủa, thêm H2SO4 dư vào nước lọc thấy tạo ra 46,6 (g) kết tủa.
Xác định nồng độ phần trăm của Na2SO4 và K2SO4 trong dung dịch A ban đầu?







