TÓM TẮT CHƯƠNG CHẤT KHÍ
A)Tổng hợp lí thuyết:
1,Cấu tạo chất khí:
1.1, Cấu trúc và tính chất của chất khí:
-Mỗi chất khí được tạo thành từ các phân tử giống hệt nhau. Mỗi phân tử có thể có một hoặc nhiều nguyên tử.
-Khi đựng trong bình kín, chất khí chiếm toàn bộ dung tích của bình chứa – ta nói chất khí có tính bành trướng.
-Chất khí dễ nén, khi tăng áp suất tác dụng lên một lượng khí thì thể tích chất khí giảm đi đáng kể.
-Chất khí có khối lượng riêng nhỏ hơn chất rắn và chất lỏng.
1.2,Lượng chất và mol:
-Lượng chất chứa trong một vật được xác định theo số phân tử hay nguyên tử chứa trong chất ấy.
-Lượng chất đo bằng mol: 1 mol là lượng chất trong đó số phân tử hay nguyên tử bằng số nguyên tử chứa trong 12 g cacbon 12.
-Số Avogadro: ${{N}_{A}}=6,{{02.10}^{23}}mo{{l}^{-1}}$.
-Khối lượng mol kí hiệu là: (đọc là muy). Ở đktc 1 mol (${{t}_{0}}={{0}^{0}}C$ và p$_{0}$ = 1 atm) thể tích 1 mol khí bất kì đều bằng V$_{0}$ = 22,4 l/mol.
-Khối lượng 1 phân tử khí: ${{m}_{0}}=\frac{\mu }{{{N}_{A}}}$
-Số mol chứa trong khối lượng m của một chất: $v=\frac{m}{\mu }$
-Số nguyên tử hay phân tử chứa trong khối lượng m của một chất:
$N=v.{{N}_{A}}=\frac{m}{\mu }.{{N}_{A}}$
-Mật độ phân tử khí (n) là số phân tử khí có trong một đơn vị thể tích:
$n=\frac{N}{V}$
1.3, Thuyết động học phân tử chất khí:
-Chất khí bao gồm các phân tử, kích thước mỗi phân tử rất nhỏ coi như một chất điểm.
-Các phân tử khí chuyển động hỗn loạn không ngừng, chuyển động này phụ thuộc vào nhiệt độ, không có xu hướng ưu tiên và gọi là chuyển động nhiệt của các phân tử khí.
-Khi chuyển động các phân tử va chạm với nhau và với thành bình… Khi rất nhiều phân tử khí va chạm với thành bình gây ra áp suất chất khí lên thành bình chứa.
1.4, Cấu tạo phân tử của vật chất:
-Vật chất được cấu tạo từ các phân tử hoặc nguyên tử. Phân tử chuyển động nhiệt không ngừng.
-Ở thể khí các phân tử ở xa nhau, lực tương tác giữa các phân tử rất yếu và do đó chất khí luôn chiếm đầy bình chứa, không có hình dạng và thể tích xác định.
-Ở thể rắn và thể lỏng các phân tử được sắp xếp gần nhau và theo một trật tự nhất định, lực liên kết giữa các phân tử lớn hơn chất khí vì vậy ở thể rắn và thể lỏng vật chất có thể tích xác định, nhưng chất lỏng chưa có hình dạng ổn định như chất rắn.
2,Quá trình đẳng nhiệt – Định luật Bôi lơ – Mariot:
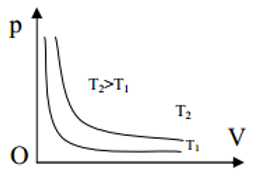
-Nhiệt độ tuyệt đối (K): T = t + 273.
-Nội dung định luật: Trong quá trình đẳng nhiệt của một lượng khí nhất định, áp suất tỉ lệ nghịch với thể tích.
-Biểu thức định luật: p.V = hằng số.
Xét ở hai trạng thái (1) và (2), ta có biểu thức: ${{p}_{1}}{{V}_{1}}={{p}_{2}}{{V}_{2}}$
-Đường đẳng nhiệt: Đường đẳng nhiệt là đồ thị biểu diễn quan hệ giữa áp suất p và thể tích V của một lượng khí xác định ở nhiệt độ không đổi. Trong hệ tọa độ p – V đường đẳng nhiệt là đường hyperbol.
3,Quá trình đẳng tích – Định luật Sác – lơ:
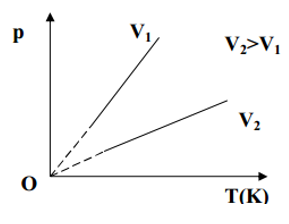
-Nội dung đinh luật: Trong quá trình đẳng tích của một lượng khí nhất định, áp suất tỉ lệ thuận với nhiệt độ tuyệt đối.
-Biểu thức: $\frac{p}{T}$ = hằng số.
Xét ở hai trạng thái (1) và (2), ta có biểu thức: $\frac{{{p}_{1}}}{{{T}_{1}}}=\frac{{{p}_{2}}}{{{T}_{2}}}$
-Đường đẳng tích: Trong hệ tọa độ (p,T) đường đẳng tích là đường thẳng mà nếu kéo dài sẽ đi qua gốc tọa độ.
4,Quá trình đẳng áp – Định luât Gay – Luyxac:
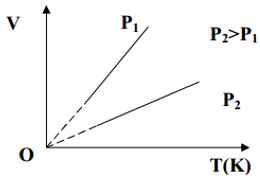
-Nội dung quy luật: Trong quá trình đẳng áp của một lượng khí nhất định, thể tích tỉ lệ thuận với nhiệt độ tuyệt đối.
-Biểu thức định luật: $\frac{V}{T}$ = hằng số.
Xét ở hai trạng thái (1) và(2): $\frac{{{V}_{1}}}{{{T}_{1}}}=\frac{{{V}_{2}}}{{{T}_{2}}}$
-Đường đẳng áp: Đường đẳng áp là đồ thị biểu diễn quan hệ giữa thể tích và nhiệt độ của một lượng khí xác định ở áp suất không đổi.
5,Phương trình trạng thái lí tưởng. Phương trình Claperon – Mendeleev:
5.1, Khí thực và khí lí tưởng:
-Các khí thực chỉ tuân theo gần đúng các định luật về chất khí.
-Khi ở nhiệt độ thấp, sự khác biệt giữa khí thực và khí lí tưởng không quá lớn nên ta có thể áp dụng các định luật về chất khí.
5.2, Phương trình trạng thái của khí lí tưởng:
-Phương trình trạng thái của khí lí tưởng là phương trình biểu thị mối quan hệ giữa 3 thông số trạng thái (p, V, T) của một khối lượng khí xác định.
-Phương trình: $\frac{pV}{T}$ = hằng số.
-Xét ở hai trạng thái (1) và (2): $\frac{{{p}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{p}_{2}}{{V}_{2}}}{{{T}_{2}}}$.
5.3, Phương trình Claperon – Mendeleev:
-Phương trình Claperon – Mendeleev: là phương trình biểu thị mối quan hệ giữa 3 thông số trạng thái (p, V, T) và khối lượng (hoặc số mol) của một lượng khí.
-Phương trình: pV = n.R.T = $\frac{m}{\mu }$.R.T
Trong đó:
+ R : là hằng số của khí lí tưởng. R = 8,314 J/mol.K với p (Pa), V (m$^{3}$)
R = 0,082 L.atm/mol.K với p (atm), V (lít)
+ $\mu $ : là khối lượng mol nguyên tử (g).
+ m : là khối lượng nguyên tử (g).
+ n : là số mol.
B)Bài tập tự luyện:
Câu 1: Tích của áp suất p và thể tích V của một khối lượng khí lí tưởng xác định thì:
A.Không phụ thuộc vào nhiệt độ.
B.Tỉ lệ thuận với nhiệt độ tuyệt đối.
C.Tỉ lệ thuận với nhiệt độ Xenxiut.
D.Tỉ lệ nghịch với nhiệt độ tuyệt đối.
Câu 2: Khi làm nóng đẳng tích một lượng khí lí tưởng xác định, đại lượng nào sau đây không đổi?
A.n/p B.n/T C.p/T D.nT
Câu 3: Chuyển động nào sau đây là chuyển động của riêng các phân tử ở thể lỏng?
A.Chuyển động hỗn loạn không ngừng.
B.Dao động xung quanh các vị trí cân bằng cố định.
C.Chuyển động hoàn toàn tự do.
D.Dao động xung quanh các vị trí cân bằng không cố định.
Câu 4: Tìm câu sai:
A.Các chất được cấu tạo từ các hạt riêng gọi là nguyên tử, phân tử.
B.Các nguyên tử, phân tử đứng sát nhau và giữa chúng không có khoảng cách.
C.Lực tương tác giữa các phân tử ở thể rắn lớn hơn lực tương tác giữa các phân từ ở thể lỏng và thể khí.
D.Các nguyên tử, phân tử chất lỏng dao động xung quanh các vị trí cân bằng không cố định.
Câu 5: Đặc điểm nào sau đây không phải đặc điểm của quá trình đẳng nhiệt?
A.Nhiệt độ khối khí tăng thì áp suất tăng.
B.Nhiệt độ của khối khí không đổi.
C.Khi áp suất tăng thì thể tích khối khí giảm.
D.Khi thể tích khối khí tăng thì áp suất giảm.
Câu 6: Khi đun nóng đẳng tích một khối khí thêm 1$^{0}$C thì áp suất khối khí tăng thêm 1/360 áp suất ban đầu. Nhiệt độ ban đầu của khối khí đó là:
A.87$^{0}$C B.360$^{0}$C C.350$^{0}$C D.361$^{0}$C
Câu 7: Một bóng đèn dây tóc chứa khí trơ ở 27$^{0}$C và áp suất 0,6 atm. Khi đèn sáng, áp suất không khí trong bình là 1 atm và không làm vỡ bóng đèn. Coi dung tích của bóng đèn không đổi, nhiệt độ của khí trong đèn khi cháy sáng là:
A.500$^{0}$C B.227$^{0}$C C.450$^{0}$C D.380$^{0}$C
Câu 8: Một khối khí lí tưởng nhốt trong bình kín. Tăng nhiệt độ của khối khí từ 100$^{0}$C lên 200$^{0}$C thì áp suất trong bình sẽ:
A.Có thể tăng hoặc giảm.
B.Tăng lên hơn 2 lần áp suất cũ.
C.Tăng lên ít hơn 2 lần áp suất cũ.
D.Tăng lên đúng bằng 2 lần áp suất cũ.
Câu 9: Một bình chứa khí Hidro nén có dung tích 20 lít ở nhiệt độ 27$^{0}$C được dùng để bơm khí vào 100 quả bóng, mỗi quả bóng có dung tích 2 lít. Khí trong quả bóng phải có áp suất 1 atm và ở nhiệt độ 17$^{0}$C. Bình chứa khí nén phải có áp suất bằng:
A.10 atm B.11 atm C.17 atm D.100 atm
Câu 10: Hai bình thủy tinh A và B cùng chứa khí Heli. Áp suất ở bình A gấp đôi áp suất ở bình B. Dung tích của bình B gấp đôi bình A. Khi bình A và B cùng nhiệt độ thì:
A.Số nguyên tử ở bình A nhiều hơn số nguyên tử ở bình B.
B.Số nguyên tử ở bình B nhiều hơn số nguyên tử ở bình A.
C.Số nguyên tử ở hai bình như nhau.
D.Mật độ nguyên tử ở hai bình như nhau.
Đáp án:
|
1 |
2 |
3 |
4 |
5 |
|
B |
A |
D |
B |
A |
|
6 |
7 |
8 |
9 |
10 |
|
A |
B |
C |
B |
C |







