Câu hỏi lý thuyết dãy điện hóa – ăn mòn kim loại
Nhằm khắc sâu kiến thức lý thuyết quan trọng của chuyên đề đại cương về kim loại, mình viết thêm câu hỏi lý thuyết về dãy điện hóa -ăn mòn kim loại để các bạn 2k1 có thể luyện tập thêm. Cố gắng lên các bạn nhé! Trong đề thi THPT Quốc Gia môn Hóa, lý thuyết chiếm 60% và là phần có thể ăn điểm dễ nếu các bạn chăm chỉ!!!
Phần 1. Củng cố lý thuyết (mình đã viết trong chuyên đề Đại cương Kim loại, sau đây mình sẽ bổ sung để các bạn tiện theo dõi)
A. Dãy điện hóa:
-
Nguyên
tắc sắp xếp: Từ trái sang phải:
+ Tính khử kim loại giảm dần
+ Tính oxi hóa ion kim loại tăng dần
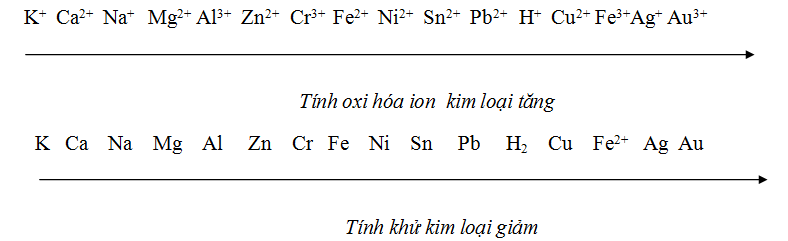
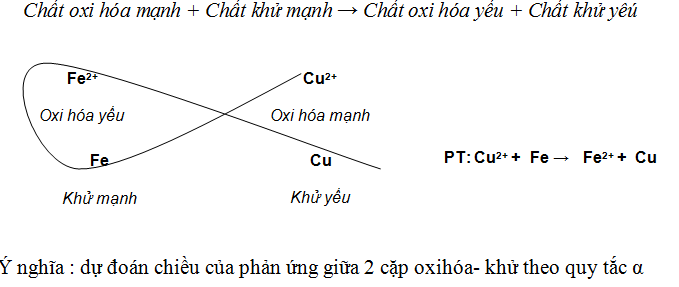
B. Ăn mòn kim loại
I. Khái niệm :Là sự phá hủy kim loại hoặc hợp kim do tác dụng các chất trong
môi trường xung quanh
II. Các dạng ăn mòn kim loại : Có 2 dạng ăn mòn kim loại: Hóa học và điện
hóa
1.
Ăn
mòn hóa học:quá trình oxi hóa khử, e của Kloại chuyển trực tiếp đến
các chất trong môi trường
2. Ăn mòn điện hóa
a. Khái
niệm: quá trình oxi hóa khử, do tác dụng chất điện li→tạo
dòng e di chuyển từ cực âm đến cực dương.
b. Điều
kiện ăn mòn: (hội tụ đủ 3 điều
kiện)
-
Có 2 điện cực khác chất ( 2 KL khác nhau , KL-PK , KL- hợp chất
..)
-
2 điện cực tiếp xúc với nhau (trực tiếp hoặc gián tiếp)
-
Đặt trong môi trường chất điện li (dung dịch ; không khí ẩm
cũng là môi trường điện li)
c. Cơ
chế ăn mòn:
- Cực âm (anot) = kim loại mạnh = quá trình oxi hóa = kim loại bị ăn mòn
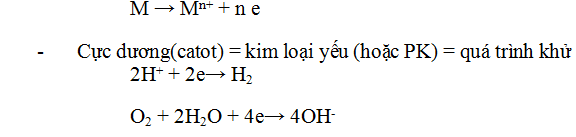
Tóm lại: Nếu ăn mòn điện hóa thì kim loại mạnh bị ăn
mòn trước
III. Chống ăn mòn kim loại
: Có 2 cách chống ăn mòn:
1.Bảo vệ bề mặt: bôi, sơn, mạ, tráng….= vật liệu bền với
môi trường
2.Phương pháp điện hóa: Dùng kim loại hoạt động hơn để
bảo vệ (kim loại hoạt động hơn sẽ bị ăn mòn trước)
Vd : Vỏ tàu biển bằng thép được gắn vào các khối kẽm( khi đó Zn bị
ăn mòn điện hóa )
Câu 1. Cho hợp kim
Mg, Al, Ni, Ag vào hỗn hợp dd Cu(NO3)2 và AgNO3. Sau
phản ứng thu được 4 kim loại. đó là:
A.
Al, Zn , Ni, Cu
B.
Ag, Cu, Ni, Zn
C.
Al, Ni, Cu, Ag
D.
Al, Zn , Ni, Ag
Câu 2. Cho một thanh
Al vào dung dịch chứa 0,03 mol HCl và 0,03 mol RCl2.sau khi phản ứng
hoàn toàn thấy khối lượng thanh Al tăng 0,96 gam. Kim loại R đó là :
A.
Ni
B.
Mn
C.
Zn
D.
Cu
Câu 3. Theo dãy thế
điện hóa của kim loại thì từ trái sang phải:
A.
Tính
khử của kim loại tăng dần và tính oxi hoá của cation kim loại tăng dần.
B.
Tính
khử của kim loại giảm dần và tính oxi hoá của cation kim loại giảm dần.
C.
Tính
khử của kim loại giảm dần và tính oxi hoá của cation kim loại tăng dần.
D.
Tính
khử của kim loại tăng dần và tính oxi hoá của cation kim loại tăng dần.
Câu 4. Dãy chỉ gồm các chất, ion tác dụng được
với ion Fe3+ trong dung dịch
là:
A.
Mg, Fe2+.
Ag
B.
Mg, Fe, Cu
C.
Fe, Cu, Ag+
D.
Mg, Cu , Cu2+
Câu 5. Dùng phản ứng
của kim loại với dung dịch muối không thể
chứng minh:
A.
Cu
có tính khử mạnh hơn Ag.
B.
Cu2+ có tính oxi hóa mạnh
hơn Zn2+.
C. Fe3+ có tính oxi hóa mạnh hơn Fe2+.
D. K có tính khử mạnh hơn Ca.
Câu 6. Trong pin
điện hóa Zn-Cu, quá trình khử trong pin là:
A. Cu → Cu2+ + 2e. B. Zn → Zn2+ + 2e.
C. Zn2 + 2e → Zn. D. Cu2+ + 2e → Cu.
(Trích đề thi tuyển sinh ĐH – CĐ
khối B – 2007)
Câu 7. Một pin điện hoá có điện cực Zn nhúng trong
dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4.
Sau một thời gian pin đó phóng điện thì khối lượng:
A.
điện
cực Zn giảm còn khối lượng điện cực Cu tăng.
B.
cả
hai điện cực Zn và Cu đều tăng.
C.
điện
cực Zn tăng còn khối lượng điện cực Cu giảm.
D.
cả
hai điện cực Zn và Cu đều giảm.
(Trích đề thi tuyển sinh ĐH – CĐ
khối A – 2008)
Câu 8. Cho các pin
điện hóa được ghép bởi các cặp oxi hóa-khử chuẩn sau:
a. Ni2+/Ni và Zn2+/Zn b. Cu2+/Cu và Hg2+/Hg
c.
Mg2+/Mg và Pb2+/Pb
Điện cực dương của các pin điện hóa đó lần
lượt là:
A.
Zn,
Hg, Pb.
B.
Ni, Hg, Pb.
C.
Ni, Cu, Mg.
D. Zn, Hg, Mg.
Câu 9. : Dãy kim loại nào dưới đây đã được xếp theo
chiều tăng dần của tính khử:
A. Al, Mg, Ca, K.
B. K, Ca, Mg, Al.
C. Al, Mg, K, Ca.
D. Ca, K, Mg,
Al.
Câu 10: Dãy gồm các kim loại đều tác dụng được với
dung dịch FeCl3
là
A. Fe, Mg,
Cu, Ag, Al. B.
Fe, Zn, Cu, Al, Mg.
C. Cu, Ag,
Au, Mg, Fe. D.
Au, Cu, Al, Mg, Zn
Câu 11: Cho hợp kim Al, Mg, Ag vào dung dịch CuCl2. Sau phản
ứng thu được hỗn hợp 3 kim loại là
A. Cu, Al, Mg.
B. Ag, Mg, Cu.
C. Al, Cu, Ag.
D. Al, Ag, Mg.
Câu 12: Cho hỗn hợp
bột Al, Fe vào dung dịch chứa Cu(NO3)2 và AgNO3. Sau khi các phản ứng xảy ra hoàn
toàn, thu được hỗn hợp rắn gồm ba kim loại là
A. Fe, Cu, Ag.
B. Al, Cu, Ag.
C. Al, Fe, Cu.
D. Al, Fe, Ag.
Câu 13 Cho các cặp oxi hóa khử:
(1): Fe2+/Fe; (2):
Pb2+/Pb; (3): 2H+/H2; (4): Ag+/Ag;
(5): Na+/Na; (6): Fe3+/Fe2+; (7): Cu2+/Cu.
Dãy sắp xếp theo chiều tăng dần tính oxi hóa
của các ion kim loại là:
A. (5) < (1) < (2) < (3) < (7) <
(6) < (4).
B. (4) < (6) < (7) < (3) < (2) <
(1) < (5).
C. (5) < (1) < (6) < (2) < (3) <
(4) < (7).
D. (5) < (1) < (2) < (6) < (3) <
(7) < (4).
Câu 14. : Cho hai thanh sắt có khối lượng bằng
nhau.
-
Thanh 1 nhúng vào dung dịch
có chứa a mol AgNO3.
-
Thanh 2 nhúng vào dung dịch có chứa a mol Cu(NO3)2. Sau
phản ứng lấy thanh
sắt ra, sấy khô và cân lại, ta thấy
A.
Khối lượng hai thanh
sau nhúng vẫn bằng nhau nhưng khác ban đầu.
B.
Khối lượng thanh 2 sau
nhúng nhỏ hơn khối lượng thanh 1 sau
nhúng.
C.
Khối lượng thanh 1 sau nhúng nhỏ hơn khối lượng thanh
2 sau nhúng.
D.
Khối
lượng 2 thanh không đổi vẫn như trước khi nhúng.
Câu 15 Cho x mol Mg vào dung dịch chứa y mol Cu(NO3)2 và z mol AgNO3, sau khi kết thúc
phản ứng thu được dung dịch 2 muối. Mối quan hệ giữa x, y, z là
A. 0,5z ≤ x < 0,5z + y. B. z ≤ a < y + z.
C. 0,5z ≤ x ≤ 0,5y + z. D. x < 0,5z + y.
Câu 16. Một pin điện hoá có điện cực Zn nhúng trong
dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4.
Sau một thời gian pin đó phóng điện thì khối lượng:
A.
điện cực Zn giảm còn khối lượng
điện cực Cu tăng.
B.
cả hai điện cực Zn và Cu đều
tăng.
C.
điện cực Zn tăng còn khối lượng
điện cực Cu giảm.
D.
cả hai điện cực Zn và Cu đều giảm.
(Trích đề thi tuyển sinh ĐH – CĐ
khối A – 2008)
Câu 17. Dãy các ion xếp theo chiều giảm dần tính oxi
hoá là (biết trong dãy điện hóa, cặp Fe3+/Fe2+ đứng trước
cặp Ag+/Ag):
A. Ag+, Cu2+, Fe3+, Fe2+ B. Fe3+, Fe2+, Cu2+, Ag+
C. Ag+, Fe3+, Cu2+, Fe2+ D. Fe3+, Ag+, Cu2+, Fe2+
(Trích đề thi tuyển sinh ĐH – CĐ
khối A – 2007)
Câu 18: Cho các ion
kim loại: Zn2+, Sn2+, Ni2+, Fe2+,
Pb2+. Thứ tự tính oxi hoá giảm dần là:
A. Pb2+ > Sn2+ > Fe2+>
Ni2+ > Zn2+. B. Pb2+
> Sn2+ > Ni2+ > Fe2+> Zn2+.
C. Sn2+
> Ni2+ > Zn2+> Pb2+ > Fe2+. D. Zn2+>Sn2+ > Ni2+
> Fe2+> Pb2+.
(Trích đề thi tuyển sinh Cao đẳng
– 2007)
Câu 19. Khi điều chế
khí H2 bằng cách cho Zn tác dụng với H2SO4
loãng. Để tăng hiệu suất người ta áp dụng cách nào sau đây:
A.nhỏ thêm vài giọt CuSO4
B.
nhỏ thêm vài giọt
AgNO3
C.
dùng lá Zn không nguyên
chất
D.tất cả đều được
Câu 20. Để điều chế H2
bằng phản ứng giữa Zn với axit H2SO4
loãng, người ta cho vài giọt CuSO4
, khi đó Cu sinh ra bám vào Zn tạo
thành pin điện. hãy cho biết trong pin điện đó, tại anot xảy ra quá trình gì?
A.Khử H+
B.
Khử Zn+
C.
Oxh H+
D.Oxh Zn
Câu 21. Một sợi dây
phơi quần áo bằng Cu nối với một đoạn dây Al để trong không khí. Hiện tượng và
kết luận nào sau đây là không đúng?
A.Chỗ nối của hai kim loại Cu – Al trong
tự nhiên xảy ra ăn mòn điện hóa
B.
Al là cực âm bị ăn
mòn mạnh
C.
Không nên nối bằng 2 kim
loại khác nhau nên nối bằng đoạn Cu
D.Cu là cực âm bị ăn mòn mạnh
Câu 22. Trong quá
trình ăn mòn điện hóa, khi nhúng miếng gang ( hợp kim Fe-C) vào dung dịch H2SO4
loãng dư, hãy cho biết tại cực dương xảy ra quá trình gì?
A.
Oxh Fe
B.
Khử Fe
C.
Oxh H+
D.
Khử H+
Câu 23. Hãy
chỉ ra trường hợp nào sau đây vật dụng bị ăn mòn điện hóa:
A. ống dẫn
khí đốt bằng hợp kim sắt đặt trong lòng đất
B. vật dụng bằng Fe đặt trong phân
xưởng sản xuất có sự hiện diện của khí Clo
C. thiết bị bằng kim loại ở lò đốt
D. ống dẫn hơi nước bằng Fe
Câu 24. Cho các phản ứng sau:
AgNO3
+ Fe(NO3)2 → Fe(NO3)3 + Ag.
Fe + CuSO4
→ FeSO4 + Cu.
Cu + Fe(NO3)3
→ Fe(NO3)2 + Cu(NO3)2.
Cu + 2AgNO3
→ Cu(NO3)2 + 2Ag.
Thứ tự về tính khử có thể rút ra từ các phản
ứng trên là:
A. Ag < Fe2+ < Cu < Fe. B. Ag > Fe2+ > Cu >
Fe .
C. Fe < Cu < Ag < Fe2+ D. Cu > Ag > Fe2+ > Fe.
Câu 25. Cho các phản ứng:
K2Cr2O7
+ 14HBr → 3Br2 + 2KBr + 2CrBr3 + 7H2O Br2
+2NaI → 2NaBr + I2
Khẳng định nào sau đây là đúng:
A. Tính oxi hoá: I2 > Cr2O72- .
B. Tính khử: Cr3+ > I- .
C. Tính khử: Br-
> Cr3+.
D. Tính oxi hoá: I2
> Br2
Câu 26. Cho 2 phản ứng sau:
Cu+2 FeCl3
→ CuCl2+ 2FeCl2(1)
Fe+CuCl2 → FeCl2+Cu (2)
Kết luận nào dưới đây là đúng:
A. Tính oxi hoá của Cu2+ > Fe3+ > Fe2+
B. Tính oxi hoá của Fe3+ > Cu2+
> Fe2+
C. Tính khử của Cu > Fe2+ > Fe.
D. Tính khử của Fe2+ > Fe > Cu.
Câu 27. : Cho biết các phản ứng xảy ra sau:
2FeBr2 + Br2 → 2FeBr3.
2NaBr + Cl2 → NaCl + Br2.
Phát biểu đúng là:
A. Tính khử của Cl- mạnh hơn Br-.
B. Tính oxi hoá của Br2 mạnh hơn Cl2.
C. Tính khử của Br- mạnh hơn Fe2+.
D. Tính oxi hoá của Cl2 mạnh hơn của Fe3+.
Câu 28. Hai
kim loại X, Y và các dung dịch muối clorua của chúng có các phản ứng hóa học
sau: X + 2YCl3→XCl2+ 2YCl2;
Y + XCl2 →YCl2+ X.
Phát biểu đúng là:
A.
Ion
Y2+ có tính oxi hóa mạnh hơn ion
X2+.
B.
Kim loại X khử được ion Y2+.
C.
Kim
loại X có tính khử mạnh hơn kim loại Y.
D.
Ion Y3+ có tính oxi
hóa mạnh hơn ion X2+.
(Trích đề thi tuyển sinh Cao đẳng
– 2008)
Câu 29. Cho 3 phản ứng:
2Al + Fe2O3 → Al2O3
+ 2Fe
Fe + CuSO4 → FeSO4 + Cu
Cu + 2AgNO3
→ Cu(NO3)2 + 2Ag
Theo 3 phản ứng trên, tính khử của kim loại
giảm theo thứ tự là:
A. Ag > Cu > Fe > Al. B. Ag < Cu < Fe < Al.
C. Fe > Cu > Ag > Al. D. Al > Fe > Cu >Ag.
Câu 30. Cho
một cây đinh Fe vào dung dịch muối Fe3+ thì màu của dung dịch chuyển
từ vàng (Fe3+) sang lục nhạt (Fe2+). Fe làm mất màu xanh
của dung dịch Cu2+ nhưng Fe2+ không làm phai màu của dung
dịch Cu2+. Dãy sắp xếp các theo thứ tự tính khử tăng dần là:
A. Fe2+ < Fe < Cu.
B. Fe < Cu
< Fe2+
C. Fe2+ < Cu < Fe.
D. Cu < Fe < Fe2+
Câu 31: Biết rằng
dung dịch HCl tác dụng với Fe cho ra Fe2+, nhưng không tác dụng với
Cu. HNO3 tác dụng với Cu tạo ra Cu2+ nhưng không tác dụng
Au cho ra Au3+. Dãy sắp xếp các ion Fe2+, H+,
Cu2+, NO3-, Au3+ theo thứ tự độ
mạnh tính oxi hoá tăng dần là:
A. H+ < Fe2+ < Cu2+
< NO3- < Au3+
B. NO3- < H+
< Fe2+ < Cu2+ <
Au3+
C. H+ < Fe2+ < Cu2+
< Au3+ < NO3-
D. Fe2+ < H+ < Cu2+
< NO3- < Au3+
Câu 32: Nung nóng từng cặp chất sau trong bình kín:
(1) Fe2O3
+ CO
(k), (2) Pt + O2 (k), (3) Al + KCl (r).
(4) Cu + Fe(NO3)2 (r), (5)
Cu + NaNO3 (r), (6) Zn + S (r),
Các trường hợp xảy ra phản ứng oxi hoá kim
loại là:
A.(1), (2),
(6). B.(2), (5), (6). C.(2), (3), (4). D.(4), (5), (6).
Câu 33: Cho các chất
:Al, Fe và các dung dịch :Fe(NO3)2, AgNO3,
NaOH, HCl lần lượt tác dụng với nhau từng đôi một . Số phản ứng oxi hóa khử
khác nhau nhiều nhất có thể xảy ra là:
A. 7. B. 10. C. 9. D. 8.
Câu 34. Có các
thí nghiệm sau:
-
TN1. Cho hơi nước đi
qua ống đựng bột sắt nung nóng
-
TH2. Cho đinh sắt
nguyên chât vào dung dịch H2SO4 loãng có nhỏ thêm vài giọt
dung dịch CuSO4
-
TN3. Để thanh thép
trong kk ẩm
-
TN4. Nhúng lá kẽm
nguyên chất vào dung dịch CuSO4
-
TN5. Thanh Fe có quấn
dây Cu và để ngoài kk ẩm
-
TN6. Hợp kim Ag- Cu
nhúng vào dd HCl
-
TN7. Hợp kim Zn-Cu
nhúng vào dd NaOH
-
TN8. Sắt mạ thiếc
nhúng vào dd HCl
Số trường hợp xảy ra
ăn mòn điện hóa học là:
A.
6
B.
3
C.
4
D.
5
Câu 35. Hai vật liệu
sắt tây ( sắt tráng thiếc) và tôn ( sắt tráng Zn) có cùng bề dày lớp mạ và đều
bị xây xát tới lớp bên trong thì trong không khí ẩm:
A.
Cả hai vật liệu bền
ngang nhau
B.
Chúng bị ăn mòn giống
nhau
C.
Sắt tây bền hơn nhôm
D.
Tôn bền hơn sắt tây
Câu 36. Hãy so sánh tốc
độ ăn mòn khi nhúng một thanh sắt tây (sắt được tráng thiếc) và một thanh hợp
kim Fe-Sn ( thu được khi nung chảy Fe, Sn) cùng vào các dung dịch HCl cùng nồng
độ và thể tích
A.
Sắt tây ăn mòn nhanh
hơn
B.
Thanh hợp kim ăn mòn
nhanh hơn
C.
2 thanh ăn mòn với tốc
độ bằng nhau
D.
Không xác định được
Câu 37. Để bảo vệ kim
loại người ta nhúng kim loại vào dd H3PO4 để tạo muối
photphat ít tan bám trên bề mặt. hãy cho biết cơ sở của pp bảo vệ kim loại trên
?
A.
Cách ly
B.
Tạo hợp kim không gỉ
C.
Dùng chất kìm hãm
D.
Phương pháp điện hóa
Câu 38. Kết luận nào
sau đây không đúng
A.
Các thiết bị máy móc
bằng kim loại tiếp xúc với hơi nước ở nhiệt độ cao có khả năng bị ăn mòn hóa học
B.
Nối thanh Zn với vỏ
tàu thủy bằng thép thì vỏ tàu thủy sẽ được bảo vệ
C.
Một miếng vỏ đồ hộp
làm bằng sắt tây ( sắt tráng thiếc) bị xây xát tận bên trong kk ẩm thì Sn bị ăn
mòn trước
D.
Để đồ vật bằng thép
ra ngoài kk ẩm thì đồ vật đó sẽ bị ăn mòn điện hóa
Câu 39. Có
một thủy thủ làm rơi đồng 50 xu bằng Zn xuống đáy tàu và quên không nhặt lại đồng
xu đó. Hiện tượng gì sẽ xảy ra sau 1 thời gian dài?
A.
Đồng xu rơi ở chỗ nào
vẫn còn nguyên chỗ đó
B.
Đồng xu biến mất
C.
Đáy tàu bị thủng dần
làm con tàu bị đắm
D.
Đồng xu nặng hơn trước
nhiều lần.
Câu 40. : Trong các
phản ứng sau
1)
Cu +
2H+ -> Cu2+ + H2.
2)
Cu + Hg2+ -> Cu2+ + Hg.
3)
Zn + Cu2+ -> Zn2+
+ Cu.
Các phản ứng
xảy ra theo chiều thuận là:
2, 3. B. Chỉ có 1. C. Chỉ
có 2. D. Chỉ có 3.
Câu 41. Dãy nào sau đây chỉ gồm các chất vừa tác dụng
được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3:
A. Fe, Ni, Sn. B. Al,
Fe, CuO. C.
Zn, Cu, Mg. D. Hg, Na, Ca.
(Trích đề thi tuyển sinh Cao đẳng
– 2009)
Câu 42. Kim loại M phản ứng được với: dung dịch HCl,
dung dịch Cu(NO3)2, dung dịch HNO3 (đặc,
nguội). Kim loại M là:
A. Al . B. Zn. C. Fe. D. Ag.
Câu 43. Cho các dung dịch:
X1:
dung dịch HCl X2:
dung dịch KNO3
X3:
dung dịch HCl + KNO3 X4: dung dịch Fe2(SO4)3.
Dung dịch có thể hoà tan được bột Cu là :
A. X1, X4, X2. B. X3, X4. C. X1, X2, X3, X4. D. X2, X3.
Câu 44. Có 4 mệnh đề sau
(1)
Hỗn hợp Na2O + Al2O3
(tỉ lệ mol 1: 1) tan hết trong nước dư
(2)
Hỗn hợp Fe2O3
+ Cu (tỉ lệ mol 1: 1) tan hết trong dung dịch HCl dư
(3)
Hỗn hợp KNO3 + Cu ( tỉ
lệ mol 1: 1) tan hết trong dung dịch NaHSO4 dư
(4)
Hỗn hợp FeS + CuS↓( tỉ lệ mol 1:1) tan hết trong dung dịch
HCl dư Số mệnh đề đúng là
A. 4 B. 3 C. 1 D. 2
Câu 45. Để khử ion Fe3+ trong dung dịch thành ion Fe2+
có thể dùng một
lượng dư:
A. kim loại Cu.
B. kim loại Ag.
C. kim loại Ba.
D. kim loại Mg.
(Trích đề thi tuyển sinh Cao đẳng
– 2007)
Câu 46. Cho dung dịch ZnSO4 có lẫn tạp
chất là dung dịch CuSO4. Hóa chất có thể dùng để loại bỏ tạp chất
là:
A. Cu dư, lọc. B. Zn
dư, lọc. C. Fe dư, lọc. D.
Al dư, lọc.
Câu 47. Một tấm vàng kim loại bị bám một lớp Fe ở bề
mặt. Ta có thể rửa lớp Fe để loại tạp chất bằng dung dịch:
A. CuSO4 dư. B. FeSO4 dư. C. FeCl3. D. ZnSO4 dư.
Câu 48. Bột Cu có lẫn
tạp chất là bột Zn và bột Pb. Hóa chất nào dưới đây có thể loại bỏ được tạp
chất:
A. dung dịch Cu(NO3)2
dư. B. dung dịch Pb(NO3)2 dư.
C. dung dịch CuCl2
. D. dung dịch AgNO3.
Câu 49. Có
các cặp chất sau:Cu và dung dịch FeCl3;
H2S và dung dịch CuSO4; HI và dung dịch FeCl3; H2S và dung dịch FeCl2;
dung dịch AgNO3 và dung
dịch Fe(NO3)2; H2S và dung dịch FeCl3.
Số cặp chất phản ứng được với nhau là
A. 5. B. 6. C. 4. D. 3.
Câu 50. Một
chiếc nồi nhôm có quai làm bằng sắt dễ hỏng hơn chiếc nồi có quai bằng nhôm. Điều
này được giải thích là do :
A.
Chiếc nồi nhôm quai sắt
bị ăn mòn hóa học
B.
Chiếc nồi nhôm quai sắt
tạo thành 1 pin điện và xảy ra quá trình ăn mòn điện hóa ở phần làm bằng nhôm
C.
Chiếc nồi nhôm quai sắt
tạo thành 1 pin điện và xảy ra quá trình ăn mòn điện hóa ở phần làm bằng sắt
D.
Chiếc nồi nhôm quai sắt
tạo thành 1 pin điện và xảy ra quá trình ăn mòn điện hóa ở cả 2 phần
Đáp án:
|
1.B |
2.A |
3.C |
4.B |
5.D |
6.D |
7.A |
8.B |
9.A |
|
10.B |
11.C |
12.A |
13.A |
14.B |
15.A |
16.A |
17.C |
18.B |
|
19.D |
20.D |
21.D |
22.D |
23.A |
24.A |
25.C |
26.B |
27.D |
|
28.D |
29.D |
30.C |
31.D |
32.D |
33.A |
34.D |
35.D |
36.B |
|
37.A |
38.C |
39.B |
40.A |
41. A |
42. B |
43.B |
44.B |
45.A |
|
46.B |
47.C |
48.A |
49.A |
50.B |
|
|
|
|







