CHUYÊN ĐỀ BÀI TẬP KIM LOẠI
KIỀM - KIỀM THỔ - NHÔM
A. CÁC DẠNG BÀI TẬP
* DẠNG 1: BÀI TOÁN
CO2, SO2 TÁC DỤNG VỚI DUNG DỊCH KIỀM
- dung dịch kiềm: NaOH,
KOH, Ba(OH)2 , Ca(OH)2 ...
I. TÁC DỤNG VỚI NaOH,
KOH
- Khi cho CO2 (hoặc SO2) tác dụng với NaOH, KOH
đều xảy ra 3 khả năng tạo muối. Ta thường lập tỉ lệ
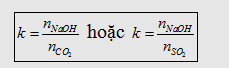
Nếu : 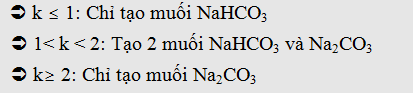
* Chú ý: Với những bài tốn không thể tính k, ta có thể
dựa vào dữ kiện đề bài đã cho để tìm ra khả năng tạo muối như thế nào.
- Hấp thu CO2 vào NaOH dư chỉ tạo muối Na2CO3
- Hấp thu CO2 dư vào NaOH chỉ tạo muối NaHCO3
- Hấp thu CO2 vào NaOH tạo dd muối. Sau đó thêm BaCl2
vào dd muối thấy có kết tủa, thêm tiếp Ba(OH)2 dư vào thấy xuất hiện
thêm kết tủa: Tạo 2 muối Na2CO3 và NaHCO3
- Nếu bài tóan không cho bất kì dữ liệu nào thì phải chia trường hợp để
giải.
II. TÁC DỤNG VỚI
Ca(OH)2, Ba(OH)2
Tương tự như trên, trường hợp này cũng có 3 khả năng tạo muối, ta lập tỉ
lệ:
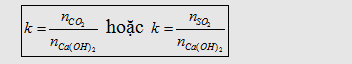
Nếu : 
* Chú ý: Với những bài tốn không thể tính k, ta có thể
dựa vào dữ kiện đề bài đã cho để tìm ra khả năng tạo muối như thế nào.
- Hấp thu CO2 vào nước vôi trong dư chỉ tạo muối CaCO3
- Hấp thu CO2 dư vào nước vôi trong (lúc đầu có kết tủa
trắng, sau đó kết tủa tan): chỉ tạo muối Ca(HCO3)2
- Hấp thụ CO2 vào nước vôi trong thấy tạo kết tủa, sau đó
thêm NaOH dư vào thấy có kết tủa nữa: Tạo 2 muối
- Hấp thụ CO2 vào nước vôi trong thấy tạo kết tủa, lọc bỏ kết
tủa rồi đun nóng nước lọc lại thấy kết tủa nữa: tạo 2 muối.
- Nếu bài tóan không cho bất kì dữ liệu nào thì phải chia trường hợp để
giải.
III. TÁC DỤNG VỚI HỖN
HỢP GỒM CẢ NaOH / KOH VÀ Ca(OH)2
/ Ba(OH)2
Lập tỉ lệ: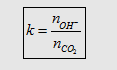
Nếu : 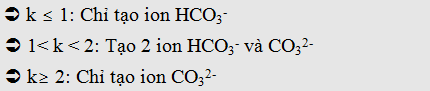
* Chú ý: PTHH tạo muối: 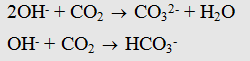
µ Hai dạng tóan này có
một số công thức giải nhanh.
1. Công thức tính lượng kết tủa xuất
hiện khi hấp thụ hết một lượng CO2 vào dd Ca(OH)2 hoặc
Ba(OH)2 :
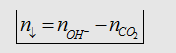
- Sử dụng công
thức trên với điều kiện: 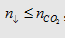 nghĩa là
bazơ phản ứng hết.
nghĩa là
bazơ phản ứng hết.
- Nếu bazơ dư
thì 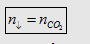
2. Công thức tính lượng kết tủa xuất hiện khi hấp
thụ hết một lượng CO2 vào dd chứa hỗn hợp gồm NaOH và Ca(OH)2
hoặc Ba(OH)2 :
- Trước hết tính 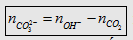 rồi so sánh với
rồi so sánh với 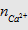 hoặc
hoặc 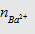 để xem chất nào phản ứng hết. Lượng kết tủa
tính theo số mol chất phản ứng hết.
để xem chất nào phản ứng hết. Lượng kết tủa
tính theo số mol chất phản ứng hết.
-
Điều kiện là: 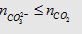
3.
Công thức tính 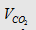 cần hấp thụ hết vào 1 dd Ca(OH)2
hoặc Ba(OH)2 để thu được 1 lượng kết tủa theo yêu cầu:
cần hấp thụ hết vào 1 dd Ca(OH)2
hoặc Ba(OH)2 để thu được 1 lượng kết tủa theo yêu cầu:
Dạng này có 2 kết quả: 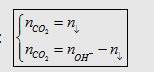
Bài tập mẫu:
Câu 1. Hấp thụ hoàn toàn 2,24 lit khí CO2 (đktc) vào dung dịch CaOH)2 dư, thu
được m gam kết tủa. Giá trị của m là:
A.
19,70
B.
10,00
C.
1,97
D.
5,00
Hướng dẫn giải: nCO2 = 0,1 mol.
Vì dung dịch Ca(OH)2 dư nên phản ứng chỉ
tạo muối trung hòa CaCO3
è
nCaCO3 = nCO2 = 0,1 mol ->
mCaCO3 = 0,1. 100= 10 g =>
Đáp án B
Câu 2. Cho 0,448 lit CO2 ( ở đktc) hấp thụ
hết 100ml dung dịch chứa NaOH 0,06M và Ba(OH)2 0,12M thu được m gam
kết tủa. Giá trị của m là:
A.
1,182.
B.
3,940
C.
1,970
D.
2,364
Hướng dẫn giải:
nCO2
= 0,02 mol ; nNaOH = 0,006 mol ; nBa(OH)2 = 0,012 mol .
nOH = 0,006 + 0,012 . 2 = 0,03 mol
k= nOH : nCO2 = 0,03/0,02 = 1,5
nCO3 = nOH – nCO2 = 0,03 – 0,02
= 0,01 < nBa
=> nBaCO3 = nCO3 =0,01 mol
-> mkết tủa = mBaCO3 = 0,01 . 197 = 1,97 gam
ð
Đáp án C
Bài tập tự luyện:
Câu 1: Đốt cháy
hồn tồn 0,1mol C2H5OH rồi hấp thụ tồn bộ sản phẩm cháy
vào bình chứa 75ml dd Ba(OH)2 2M. Tổng khối lượng muối thu được sau
phản ứng là?
A. 32,65g B. 19,7g C. 12,95g D. 35,75g
Câu 2 (CĐ KA – 2010): Hấp thụ hồn tồn 3,36 lít CO2
(đktc) vào 125ml dd Ba(OH)2 1M, thu được dd X. Coi thể tích dd không
thay đổi, nồng độ mol chất tan trong dd X là?
A. 0,4M B. 0,2M C. 0,6M D. 0,1M
Câu 3: Hấp thụ hết 11,2 lít CO2
(đktc) vào 350 ml dd Ba(OH)2 1M. Tính khối lượng kết tủa thu được?
A. 39,4g B. 78,8g C.
19,7g D. 20,5g
Câu 4: Hấp thụ hết 1,344 lít CO2 (đktc) vào 350 ml dd Ca(OH)2
1M. Tính khối lượng kết tủa thu được?
A. 64g B. 10g C.
6g D. 60g
Câu 5: Hấp thụ hết 7,84 lít CO2 (đkc) vào 300ml dung dịch Ba(OH)2
1M. Tính khối lượng kết tủa thu được?
A. 19,7g B. 49,25g C.
39,4g D. 10g
Câu 6: Hấp thụ hết 6,72 lít CO2 (đkc) vào
300ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,6M. Tính khối lượng
kết tủa thu được?
A. 15g B.
35,46g C. 19,7g D. 17,73g
Câu 7: Hấp thụ 13,44l CO2 (đktc) vào 500ml
dd hỗn hợp NaOH 1M và Ca(OH)2 0,2M. Khối lượng kết tủa thu được?
A. 20g B. 10g C.
30g D. 15g
Câu 8: Hấp thụ hết V lít CO2 (đkc) vào 300ml dung dịch Ba(OH)2
1M được 19,7 gam kết tủa. Tìm V?
A. 2,24 lít B. 11,2 lít C. 2,24 hoặc 11,2 lít D. 2,24 hoặc 3,36 lít
Câu 9: Hấp thụ 10 lít hỗn hợp CO2 và N2 (đktc) vào 200ml
dd Ca(OH)2 0,2M thấy tạo thành 1g kết tủa. Tính %VCO2
trong hỗn hợp đầu?
A. 2,24% B. 15,68% C.
2,24% hoặc 4,48% D. 2,24% hoặc 15,68%
Câu 10 (ĐHKA – 2008): Hấp thụ hồn tồn 4,48 lít khí CO2 ở đktc vào
500ml dd hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết
tủa. Giá trị của m là?
A. 19,7g B. 17,73g C.
9,85g D. 11,82g
Câu 11 (ĐHKA – 2007): Hấp thụ hồn tồn 2,688 lít CO2 (đktc) vào 2,5
lít dd Ba(OH)2 nồng độ a mol/lít, thu được 15,76g kết tủa. Giá trị
của a là?
A. 0,032M B. 0,048M C.
0,06M D. 0,04M
Câu 12 (ĐHKB – 2007): Nung 13,4g hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị
2, thu được 6,8g chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dd
NaOH 1M, khối lượng muối khan thu được sau phản ứng là?
A. 5,8g B. 6,5g C.
4,2g D. 6,3g
* DẠNG 2: KIM LOẠI KIỀM – KIỀM THỔ - NHÔM TÁC DỤNG VỚI
NƯỚC
- Khi
cho KL kiềm, kiềm thổ (trừ Mg, Be) tác dụng với nước ở nhiệt độ thường theo
phản ứng:
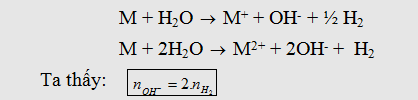
- Nếu có kim loại Al (hoặc Zn) thì OH- sẽ
tác dụng với Al: Al + OH- + H2O -> AlO2- + 3/2 H2
↑
Câu 1: Cho một mẫu hợp kim K-Ca tác
dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (ở đktc).
Thể tích dung dịch axit HCl 2M cần dùng để trung hồ dung dịch X là
A. 150ml. B. 75ml. C. 60ml. D. 30ml
Câu
2:
Cho m gam hỗn hợp Na, Ba vào nước thu được dung dich A và 6,72 lít khí ở (đktc).
Thể tích dung dịch hỗn hợp H2SO4 0,5M và HCl 1M để trung
hồ vừa đủ dung dịch A là:
A. 0,3 lít. B. 0,2 lít. C. 0,4 lít. D. 0,1 lít.
Câu 3: Hòa tan
m (g) K vào 200g nước thu được dung dịch có nồng độ là 2,748%. Vậy m có giá trị
là?
A. 7,8g B. 3,8g C. 39g D. 3,9g
Câu 4: Hòa tan một
lượng gồm 2 kim loại kiềm vào nước thu được 200ml dung dịch A và 1,12 lít H2
(đktc). Tìm pH của dung dịch A?
A. 12 B.
11,2 C. 13,1 D. 13,7
Câu 5 (ĐHKA – 2010): Hòa tan hồn tồn 8,94g hỗn hợp gồm Na, K,
Ba vào nước, thu được dd X và 2,688 lít khí H2 (đktc). Dung dịch Y
gồm HCl và H2SO4, tỉ lệ mol tương ứng là 4:1. Trung hòa
dd X bởi dd Y, tổng khối lượng các muối được tạo ra là?
A. 13,7g B.
18,46g C. 12,78g D. 14,62g
Câu 6 (ĐHKA – 2008):
Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1:2 và nước (dư). Sau khi
các phản ứng xảy ra hồn tồn, thu được 8,96 lít khí H2 (đktc) và m
gam chất rắn không tan. Giá trị của m là?
A. 10,8g B.
5,4g C. 7,8g D. 43,2g
Câu 7 (ĐHKB – 2007):
Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thốt ra V lít
khí. Nếu cũng cho m gam X vào dung dịch NaOH dư thì được 1,75V lít khí, (biết
thể tích các khí đo trong cùng điều kiện), thành phần phần trăm theo khối lượng
của Na trong X là?
A. 39,87% B.
77,31% C. 49,87% D. 29,87%
Câu 8: Hòa tan 46g hỗn
hợp gồm Ba và 2 kim loại kiềm A, B thuộc 2 chu kì liên tiếp vào nước thu được
dung dịch D và 11,2 lít khí (đktc). Nếu thêm 0,18 mol Na2SO4
vào dung dịch D thì sau phản ứng vẫn còn dư ion Ba2+. Nếu thêm 0,21
mol Na2SO4 vào dung dịch D thì sau phản ứng còn dư Na2SO4.
Vậy 2 kim loại kiềm là?
A. Li và Na B.
Na và K C. K và Rb D. Rb và Cs
Câu 9 (ĐHKB – 2009):
Hòa tan hồn tồn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được
500ml dung dịch chứa một chất tan có nồng độ 0,04M và 0,224 lít H2
(đktc). Kim loại M là?
A. Ca B. Ba C. K D. Na
* DẠNG 3: TÓAN VỀ
MUỐI CACBONAT
+) Phản ứng nhiệt
phân Ø Muối Hidrocacbonat cho muối cacbonat: 2MHCO3 -> M2CO3 + CO2 + H2O
M(HCO3)2 -> MCO3 + CO2
+ H2O
Ø Muối cacbonat của KL kiềm thổ chỉ bị nhiệt phân ở nhiệt độ cao cho oxit
bazo:
MCO3 -> MO + CO2
+) Phản ứng trao
đổi: Ø Với axit tạo khí
CO2
Ø Với một số muối tạo kết
tủa.
- Hay sử dụng: Định
luật bảo tồn khối lượng và Định luật tăng giảm khối lượng để giải
Lưu ý: Khi cho từ từ dd HCl vào hỗn hợp
muối cacbonat và hidrocacbonat, phản ứng xảy
ra theo trình tự:
Đầu tiên:
H+ + CO32- -> HCO3-
Sau đó: HCO3- + H+ -> CO2 + H2O
- Muối cacbonat + ddHCl -> Muối clorua + CO2 + H2O.
Tính nhanh khối lượng muối clorua bằng công thức: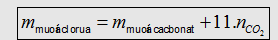
- Muối cacbonat + H2SO4
lõang -> Muối sunfat
+ CO2 + H2O. Tính nhanh khối lượng muối sufat bằng CT: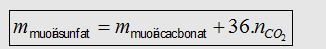
Câu 1: Khi
nung 30g hỗn hợp CaCO3 và MgCO3 thì khối lượng chất rắn
thu được sau phản ứng chỉ bằng một nửa khối lượng ban đầu. Tính thành phần %
theo khối lượng các chất ban đầu?
A.
28,41% và 71,59% B.
40% và 60% C. 13% và 87% D. 50,87% và 49,13%
Câu 2: Khi nung một lượng hidrocacbonat của kim loại hóa trị 2 và để nguội,
thu được 17,92 lít khí (đktc) và 80g bã rắn. Xác định tên muối hidrocacbonat
nói trên?
A. Ca(HCO3)2 B. NaHCO3 C. Cu(HCO3)2 D. Mg(HCO3)2
Câu 3: Nung nóng 100g hỗn hợp NaHCO3 và Na2CO3
đến khối lượng không đổi thu được 69g hỗn hợp rắn. % khối lượng của NaHCO3
trong hỗn hợp là?
A. 80% B. 70% C.
80,66% D. 84%
Câu 4 (ĐHKB – 2008): Nhiệt phân hồn tồn 40g một loại quặng đôlômit có lẫn tạp
chất trơ, sinh ra 8,96 lít CO2 (đktc). Thành phần % về khối lượng
của CaCO3.MgCO3 trong loại quặng nêu trên là?
A. 40% B. 50% C.
84% D. 92%
Câu 5: Cho 24,4g hỗn hợp Na2CO3,
K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau
phản ứng thu được 39,4g kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m
gam muối clorua. Tính m?
A. 41,6g B. 27,5g C.
26,6g D. 16,3g
Câu 6: Hòa tan hồn tồn 23,8g hỗn hợp một muối cacbonat của kim loại hóa trị I
và một muối cacbonat của kim loại hóa trị II bằng dd HCl dư thì thấy thốt ra
4,48 lít khí CO2 (đktc). Cô cạn dung dịch sau phản ứng thì lượng
muối khan thu được là?
A. 26g B. 28g C.
26,8g D. 28,6g
Câu 7: Hòa tan hồn tồn 19,2 gam hỗn hợp XCO3 và Y2CO3
vào dung dịch HCl dư thấy thốt ra 4,48 lit khí (đktc). Khối lượng muối sinh ra
trong dung dịch là:
A.
21,4 g B. 22,2 g C. 23,4 g D. 25,2 g
Câu 8: Hòa
tan hồn tồn 4 gam hỗn hợp MCO3 và M/CO3 vào
dung dịch HCl thấy thốt ra V lit khí (đktc). Cô cạn dung dịch thu được 5,1 gam
muối khan. Giá trị của V là:
A. 1,12 B.
1,68 C. 2,24 D. 3,36
Câu 9: Nung m (g) hỗn hợp X gồm 2 muối carbonat
trung tính của 2 kim loại A và B đều có hóa trị 2. Sau một thời gian thu được
3,36 lit CO2 (đkc) còn lại hỗn hợp chất rắn Y. Cho Y tác dụng hết
với dung dịch HCl dư, thì thu được ddC và khí D. Phần dung dịch C cô cạn thu 32,5g hỗn hợp muối khan. Cho khí D
thốt ra hấp thụ hồn tồn bởi dung dịch Ca(OH)2 dư thu được 15g kết
tủa. Tính m?
A. 34,15g B. 30,85g C. 29,2g D. 34,3g
Câu 10 (ĐHKA – 2010): Nhỏ từ từ từng giọt đến hết 30ml dd HCl 1M
vào 100ml dd chứa Na2CO3 và NaHCO3 0,2M, sau
phản ứng thu được số mol CO2 là?
A. 0,03 B. 0,01 C. 0,02 D. 0,015
Câu 11 (ĐHKB – 2009): Cho
từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3
đồng thời khuấy đều, thu được V lít khí (đktc) và dd X. Khi cho dư nước vôi
trong vào dd X thấy có xuất hiện kết tủa. Biểu thức liên hệ giữa V với a,b là:
A. V = 22,4(a – b) B. V = 11,2(a – b) C. V = 11,2(a + b)
D. V = 22,4(a + b)
* DẠNG 4: PHẢN ỨNG NHIỆT NHÔM
Cho
bột nhôm phản ứng với các oxit kim loại. Tính hiệu suất phản ứng hoặc thành
phần khối lượng sau phản ứng....
2yAl + 3MxOy -> yAl2O3
+ 3x M
- Chú ý:
+) Trường
hợp phản ứng xảy ra hồn tồn (H = 100%), nếu cho sản phẩm tác dụng với dung dịch
kiềm có khí H2 thốt ra thì sản phẩm sau phản ứng có Al dư , M và Al2O3.
+) Trường
hợp phản ứng xảy ra không hồn tồn (H<100%), khi đó sản phẩm có Al dư, Al2O3,
MxOy dư, M.
+ Hay sử
dụng Định luật bảo tồn khối lượng, định luật bảo tồn nguyên tố....
Câu 1: Nung nóng hỗn hợp gồm 15,2 gam Cr2O3 và m gam Al. Sau
khi phản ứng xảy ra hồn tồn thu được 23,3 gam hỗn hợp X. Cho tồn bộ X phản ứng với HCl dư thấy thốt ra V (l) H2
(đktc). Giá trị của V là:
A.
7,84 lít B.
4,48 lít C. 3,36 lít D. 10,08 lít
Câu 2 (CĐ
KA,B – 2008): Đốt nóng một hỗn hợp gồm Al và 16g Fe2O3
(trong điều kiện không có không khí) đến khi phản ứng xảy ra hồn tồn, thu được
hỗn hợp rắn X. Cho X tác dụng vừa đủ với Vml dd NaOH 1M sinh ra 3,36 lít H2
(đktc). Giá trị của V là?
A. 100ml B. 150 ml C.
200ml D. 300ml
Câu 3: Trộn
5,4g Al với 17,4g bột Fe3O4 rồi tiến hành phản ứng nhiệt
nhôm (giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe). Hòa
tan hồn tồn hỗn hợp rắn sau phản ứng bằng dd H2SO4 lỗng,
dư thì thu được 5,376 lít H2 (đktc). Hiệu suất phản ứng nhiệt nhôm
là?
A. 62,5% B. 60% C.
20% D. 80%
Câu 4 (ĐHKB –
2009): Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều
kiện không có không khí. Sau khi phản ứng xảy ra hồn tồn, thu được một hỗn hợp
rắn X. Cho X tác dụng với dd NaOH dư thu được dd Y, chất rắn Z và 3,36 lít khí
H2 (đktc). Sục khí CO2 dư vào dd Y, thu được 39 g kết tủa. Giá trị
của m là?
A. 45,6g B. 48,3g C.
36,7g D. 57g
Câu 5: Sau
khi thực hiện phản ứng nhiệt nhôm với Fe3O4 thu được chất
rắn A và nhận thấy khối lượng nhôm tăng 0,96g. Cho A tác dụng với dd NaOH dư
thu được 0,672 lít khí (đktc), giả sử hiệu suất các phản ứng là 100%, khối
lượng của a là?
A. 1,08g B. 1,62g C.
2,1g D. 5,1g
Câu 6 (ĐHKA –
2008): Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi
trường không có không khí) đến khi phản ứng xảy ra khồn tồn, thu được hỗn hợp
rắn Y. Chia Y thành 2 phần bằng nhau:
- Phần 1: Tác dụng với dd H2SO4 lỗng, dư sinh ra 3,08
lít khí H2 ở đktc.
- Phần 2: Tác dụng với dd NaOH dư sinh ra 0,84 lít khí H2 ở
đktc. Giá trị của m là?
A. 22,75g B. 21,4g C.
29,4g D. 29,43g
Câu 7: Đốt
nóng một hỗn hợp X gồm bột Fe3O4 và bột Al trong môi
trường không có không khí. Nếu cho những chất còn lại sau phản ứng tác dụng với
dung dịch NaOH dư sẽ thu được 0,3 mol H2; còn nếu cho tác dụng với
HCl dư sẽ thu được 0,4 mol H2. Vậy số mol Al trong hỗn hợp X là?
A. 0,3 mol B. 0,4 mol C.
0,25 mol D. 0,6 mol
Câu 8: Khi cho 41.4 gam hỗn hợp X gồm Fe2O3,
Al2O3 và Cr2O3 tác dụng với dung
dịch NaOH đặc, dư thu được chất rắn có khối lượng 16 gam. Để khử hồn tồn 41.4
gam X bằng phản ứng nhiệt nhôm cần dùng 10.8 gam Al. Thành phần % theo khối
lượng của Cr2O3 trong hỗn hợp X là:
A. 30,23% B. 50,67% C. 36,71% D. 66,67%
Câu 9: Tiến hành phản ứng
nhiệt nhôm hỗn hợp gồm Al và oxit Fe thu được hỗn hợp chất rắn X. Cho X tác
dụng với dung dịch NaOH dư thu được dung dịch Y, phần không tan Z và 0,672
(lít) khí (đktc). Cho dung dịch HCl vào dung dịch Y đến khi thu được lượng kết
tủa lớn nhất, lọc lấy kết tủa, nung đến khối lượng không đổi thu được 5,1 gam
chất rắn. Cho Z tác dụng với dung dịch H2SO4 đặc nóng,
sau phản ứng thu được dung dịch E chỉ chứa 1 loại muối sắt sulfat và 2,688
(lít) SO2 (đktc). Các pứ xảy ra hồn tồn. Công thức của oxit Fe là:
A. FeO hay
Fe2O3 B. FeO hay Fe3O4 C. FeO D. Fe2O3
* DẠNG 5: TÓAN VỀ SỰ
LƯỠNG TÍNH CỦA Al(OH)3, Zn(OH)2
Dạng 1: Cho từ từ a mol OH- vào dd chứa b
mol Al3+. Tìm khối lượng kết tủa.
Al3+ + 3OH- ->Al(OH)3
Nếu OH-
dư: Al(OH)3 + OH- -> AlO2-
+ H2O
- Khi đó tùy theo
tỉ lệ mol OH-; số mol Al3+ mà có kết tủa hoặc không có
kết tủa hoặc vừa có kết tủa vừa có muối tan.
Dạng này phải có hai kết quả. Công thức: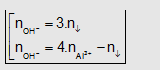
Dạng 2: Cho từ từ H+ vào dd chứa AlO2-
(hay Al(OH)4-) tạo kết tủa.
AlO2-
+ H+ + H2O -> Al(OH)3
Nếu H+
dư: Al(OH)3 + 3H+ -> Al3+ + 3H2O
- Khi đó
tùy theo tỉ lệ mol H+; số mol AlO2- mà có kết
tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan.
* Để giải nhanh
bài tốn này ta có công thức tính nhanh:
Dạng này phải có hai kết quả. Công thức: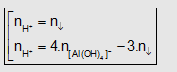
Dạng 3: Công thức 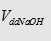 cần cho vào dd
cần cho vào dd 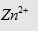 để xuất hiện 1 lượng kết tủa theo
yêu cầu:
để xuất hiện 1 lượng kết tủa theo
yêu cầu:
Dạng này có 2 kết quả: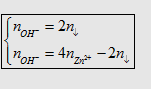
Câu 1: Cho từ từ 0,7 mol NaOH vào dd chứa 0,1 mol Al2(SO4)3.
Số mol kết tủa thu được?
A. 0,2 B. 0,15 C. 0,1 D. 0,05
Câu 2: Cho V lít dd Ba(OH)2 0,5M vào 200ml dd
Al(NO3)3 0,75M thu được 7,8g kết tủa. Giá trị của V là?
A. 0,3 và 0,6
lít B. 0,3 và 0,7 lít C. 0,4 và 0,8 lít D. 0,3 và 0,5 lít
Câu 3: dd A chứa KOH và 0,3 mol K[Al(OH)4]. Cho 1
mol HCl vào dd A thu được 15,6g kết tủa. Số mol KOH trong dd là?
A. 0,8 hoặc 1,2
mol B. 0,8 hoặc 0,4 mol C. 0,6 hoặc 0 mol D. 0,8 hoặc 0,9 mol
Câu 4: Cho 2,7g Al vào 200ml dd NaOH 1,5M thu được dd A.
Thêm từ từ 100ml dd HNO3 vào dd A thu được 5,46g kết tủa. Nông độ của HNO3
là?
A. 2,5 và 3,9M B. 2,7 và 3,6M C. 2,7 và 3,5M D.
2,7 và 3,9M
Câu 5 (ĐHKB – 2007): Cho 200ml dd AlCl3 1,5M tác
dụng với V lít dd NaOH 0,5M; lượng kết tủa thu được là 15,6g. Giá trị lớn nhất
của V là?
A. 1,2 1,8 C. 2,4 D. 2
Câu 6 (ĐHKB – 2010): Cho 150ml dd KOH 1,2M tác dụng với
100ml dd AlCl3 nồng độ x mol/l, thu được dd Y và 4,68g kết tủa. Loại
bỏ, thêm tiếp 175ml dd KOH 1,2M vào Y, thu được 2,34g kết tủa. Giá trị của x
là?
A. 1,2M B. 0,8M C. 0,9M D. 1M
Câu 7 (CĐ – 2007): Thêm m gam Kali vào 300ml dd chứa Ba(OH)2
0,1M và NaOH 0,1M thu được dung dịch X. Cho từ từ dung dịch X vào 200ml
dd Al2(SO4)3 0,1M thu được kết tủa Y. Để thu
được lượng kết tủa Y lớn nhất thì giá trị của m là?
A. 1,59g B. 1.17g C. 1,71g D. 1,95g
Câu 8 (CĐ – 2009): Hòa tan hồn tồn 47,4g phèn chua KAl(SO4)2.12H2O
vào nước, thu được dd X. Cho tòan bộ X tác dụng với 200ml Ba(OH)2 1M,
sau phản ứng thu được m gam kết tủa. Giá trị của m là?
A. 46,6g B. 54,4g C. 62.2g D. 7,8g
Câu 9 (CĐ – 2009): Nhỏ từ từ 0,25 lít dd NaOH 1,04M vào dd
gồm 0,024 mol FeCl3; 0,016 mol Al2(SO4)3
và 0,04 mol H2SO4 thu được m gam kết tủa. Giá trị của m
là?
A. 4,128g B. 2,568g C. 1,56g D. 5,064g
Câu 10 (ĐHKA – 2010): Hòa tan hồn tồn m gam ZnSO4
vào nước được dung dịch X. Nếu cho 110 ml dd KOH 2M vào X thì thu được 3a gam
kết tủa. Mặt khác, nếu cho 140ml ml dd KOH 2M vào X thì thu được 2a gam kết
tủa. Giá trị của m là?
A. 32,2g B. 24,25g C. 17,71g D. 16,1g
Câu 11: Cho 38.795 gam hỗn hợp bột nhôm và nhôm clorua vào lượng vừa đủ dung
dịch NaOH thu được dung dịch A (kết tủa vừa tan hết) và 6,72 (lít) H2
(đktc). Thêm 250ml dung dịch HCl vào dung dịch A thu được 21,84 gam kết tủa.
Nồng độ dung dịch HCl là:
A. 1.12M hay 3.84M B. 2.24M hay 2.48M C. 1.12, hay 2.48M D. 2.24M hay 3.84M







