Dạng 4: H+ phản ứng với dung dịch AlO2-
Định tính:
+ Cho từ từ dung dịch chứa H+ vào dung dịch chứa a mol AlO2- ta có 2 phản ứng xảy ra:
H+ + AlO2- + H2O → Al(OH)3↓
Al(OH)3 + 3H+ → Al3+ + 3H2O
+ Đồ thị biểu diễn hai pư trên như sau:
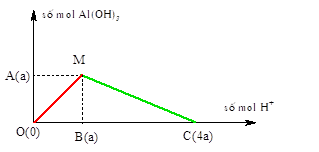
+ Ta luôn có được điều sau:
BM=BO; BC=3BM; BM=a=n↓ max
Suy ra: Phương pháp giải:
@ Dáng của đồ thị: Tam giác không cân
@ Tọa độ các điểm quan trọng
+ Điểm xuất phát: (0,0)
+ Điểm cực đại(kết tủa cực đại): (a, a) [a là số mol của Al3+] ⇒ kết tủa cực đại là a mol.
+ Điểm cực tiểu: (0, 4a)
@ Tỉ lệ trong đồ thị: (1:1) và (1:3).
Kết luận: Công thức tính nhanh:
Đường màu xanh của đồ thị ta dùng công thức: nkt=nH+
Đường màu đỏ của đồ thị ta dùng công thức: nH+ = 4nAlO2- - 3nkt
Bài tập ví dụ mẫu:
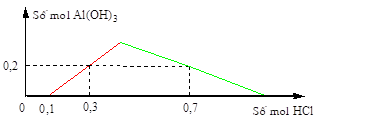
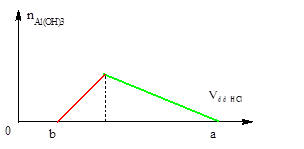
Bài 1: Cho từ từ dung dịch HCl đến dư vào dung dịch NaAlO2. Kết quả thí nghiệm được biểu diễn ở đồ thị dưới đây. Giá trị của a, b tương ứng là
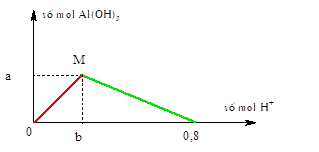
A. 0,3 và 0,2. B. 0,2 và 0,3. C. 0,2 và 0,2. D. 0,2 và 0,4.
*Gợi ý:
+ Từ đồ thị và tỉ lệ trong đồ thị ta có: a = b = $\frac{0,8}{4}$ = 0,2 mol.
+ Vậy đáp án là C.
Bài 2: Rót từ từ đến hết V lít dung dịch HCl 0,1M vào 400 ml dung dịch KAlO2 0,2M. Sau phản ứng thu được 1,56 gam kết tủa. Tính V?
.png)
*Gợi ý:
+ Vì số mol KAlO2 = 0,08 mol
+ Từ đồ thị và tỉ lệ ⇒ a = 0,02 và b = 0,32 – 3.0,02 = 0,26 mol ⇒ V = 0,2 hoặc 2,6 lít.
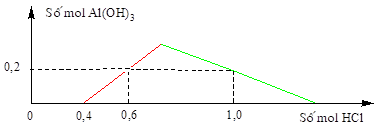
Bài 3: Rót từ từ dung dịch HCl 0,1M vào 200 ml dung dịch K[Al(OH)4] 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V (ml) dung dịch HCl như hình bên dưới. Giá trị của a và b lần lượt là:
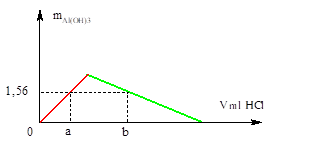
A. 200 và 1000. B. 200 và 800. C. 200 và 600. D. 300 và 800.
*Gợi ý:
+ Ta có số mol Al(OH)3 trên đồ thị = 1,56 : 78 = 0,02 mol ⇒ nH+ = 0,02 mol (1)
+ Số mol K[Al(OH)4] = 0,04 mol ⇒ kết tủa cực đại = 0,04 mol.
+ Từ đồ thị ⇒ nH+ – 0,04 = 3(0,04 – 0,02) ⇒ nH+ = 0,1 mol (2)
+ Từ (1, 2) ⇒ a = 200 ml và b = 1000 ml.
Chú ý: Khi thêm H+ vào dung dịch chứa OH- và AlO2- thì H+ pư với OH- trước sau đó H+ mới pư với AlO2-. Đồ thị của bài toán sẽ có dạng
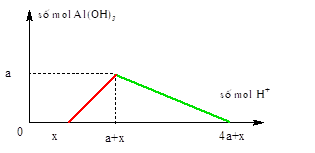
Khi đó công thức sẽ mở rộng:
Đường màu đỏ của đồ thị ta dùng công thức: nkt=nH+ - nOH-
Đường màu đỏ của đồ thị ta dùng công thức: nH+ = 4nAlO2- - 3nkt + nOH-
Bài 4: Cho dung dịch chứa x mol HCl vào dung dịch hỗn hợp chứa a mol NaAlO2 và b mol NaOH. Khuấy đều để phản ứng xảy ra hoàn toàn thì thu được dung dịch trong suốt. Điều kiện chính xác nhất của x là:
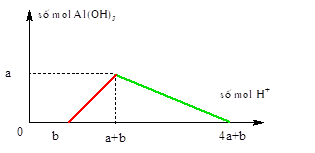
A. x ≤ b hoặc x ≥ (4a + b) B. b ≤ x ≤ (4a + b)
C. x ≤ b D. x ≥ (4a + b)
*Gợi ý:
+ Số mol NaAlO2 = a mol ⇒ kết tủa cực đại = a mol
+Từ đồ thị ⇒ để không có kết tủa thì: x ≤ b hoặc x ≥ (4a + b)
Bài 5: Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hh gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2 [hoặc Ba(AlO2)2], kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Giá trị của x và y lần lượt là
A. 0,05 và 0,15. B. 0,10 và 0,30.
C. 0,10 và 0,15. D. 0,05 và 0,30
*Gợi ý:
+ Từ đồ thị ⇒ số mol OH- = 0,1 mol ⇒ 2x = 0,1 ⇒ x = 0,05 mol.
+ Từ đồ thị ⇒ khi kết tủa tan vừa hết thì: HCl = 0,7 + 0,2.3 = 1,3 mol
⇒ kết tủa cực đại = 2y = (1,3 – 0,1):4 ⇒ y = 0,15 mol.
Vận dụng:
Bài 1: Cho 100 ml dung dịch A chứa NaOH 0,1M và Na[Al(OH)4] aM. Thêm từ từ 0,6 lít HCl 0,1M vào dung dịch A thu được kết tủa, lọc kết tủa, nung ở nhiệt độ cao đến khối lượng không đổi thu được 1,02 gam chất rắn. Giá trị của a là :
A. 0,15 . B. 0,2. C. 0,275. D. 0,25 .
Bài 2: Cho m gam NaOH vào 300 ml dung dịch NaAlO2 0,5M được dung dịch X. Cho từ từ dung dịch chứa 500 ml HCl 1,0 M vào X thu được dung dịch Y và 7,8 gam kết tủa. Sục CO2 vào Y thấy xuất hiện kết tủa. Giá trị của m là
A. 4,0 gam. B. 12,0 gam. C. 8,0 gam. D. 16,0 gam
Bài 3: Nhỏ từ từ đến dư dung dịch HCl vào dung dịch chứa x mol NaOH và y mol NaAlO2. Kết quả thí nghiệm được biểu diễn bằng đồ thị bên. Tỉ lệ x : y là
A. 1 : 3. B. 2 : 3. C. 1 : 1. D. 4 : 3.
Bài 4: Cho từ từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
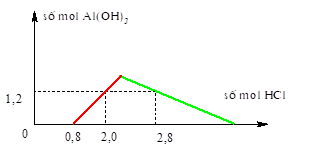
Tỉ lệ a : b là
A. 7:4 B. 4:7 C. 2:7 D. 7:2
Bài 5: Khi nhỏ từ từ V (lít) dung dịch HCl 0,1M vào 200 ml dung dịch gồm NaOH 0,1M và NaAlO2 0,1M. Kết quả thí nghiệm được biểu diễn bằng đồ thị như hình bên. Giá trị của a, b là
A. 0,4 và 1,0. B. 0,2 và 1,2.
C. 0,2 và 1,0. D. 0,4 và 1,2.
Chúc các bạn học tốt <3
Mọi thắc mắc vui lòng cmt dưới bài nha <3.







