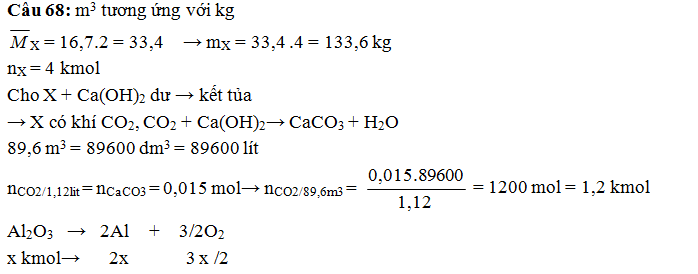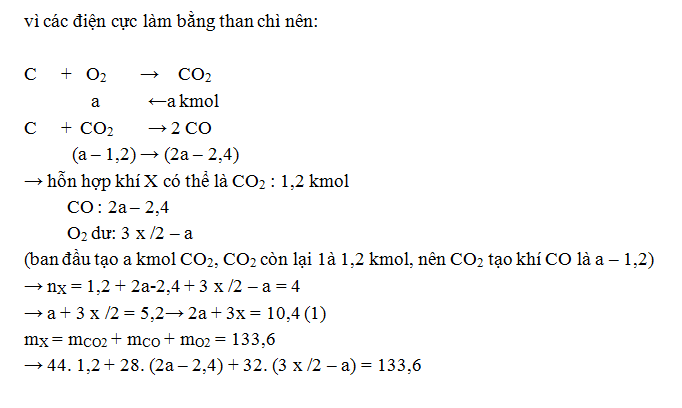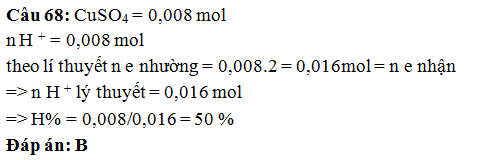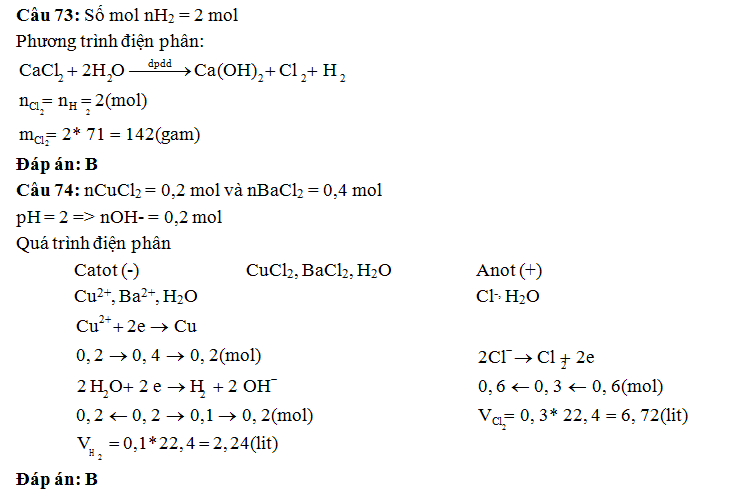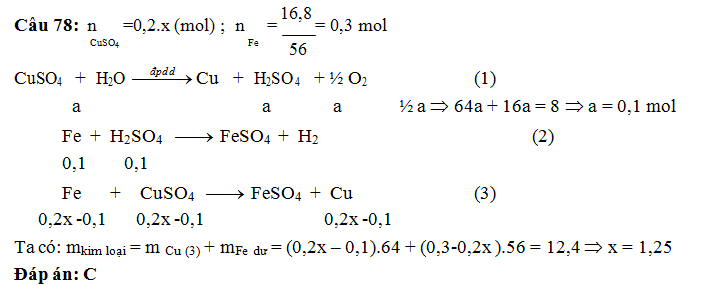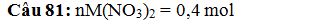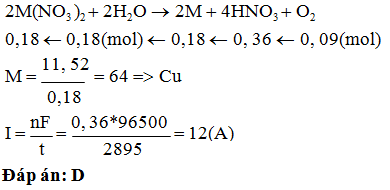Chuyên đề: Điều chế kim loại
Phần 1.
Lý thuyết.
A.
Nguyên tắc
điều chế:
Thực hiện quá trình khử ion kim loại thành kim loại
Mn+ +
ne → M
-
NX: kim loại có tính
khử mạnh khó điều chế hơn kim loại có tính khử trung bình yếu.
B.
Các
phương pháp điều chế kim loại
I.
Phương
pháp thủy luyện:
1.
Nguyên tắc:
- Dùng 1 chất tan thích hợp
(HCl, HNO3, nước cường toan, CN-…) để hòa tan các hợp chất không
tan của kim loại thành dung dịch muối, sau đó dùng 1 kim loại mạnh (không tan trong nước) đẩy kim loại yếu
khỏi dung dịch muối.
VD. Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
Zn + 2Na[Ag(CN)2]
→ Na2[Zn(CN)4] + 2Ag
2.
Phạm vi sử
dụng:
-
Pp này có
hiệu quả kinh tế không cao vì phải tiêu tốn 1 kim loại có tính khủ mạnh hơn và
kim loại thu được không nguyên chất nên phương pháp này chỉ được dùng trong
phòng thí nghiệm để điều chế các kim loại có tính khử yếu đứng sau H.
II.
Phương
pháp nhiệt luyện :
1.
Nguyên tắc
-
Dùng các chất khử như
C, CO, H2 , Al để khử ion kim loại trong oxit ở nhiệt độ cao.
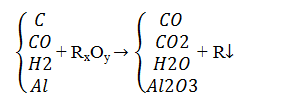
Điều kiện : R là KL trung bình -> yếu ( sau
Al)
2.
Phạm vi áp dụng:
-
Được sử dụng phổ biến
để điều chế những kim loại có tính khử Trung bình -> yếu đứng sau Al
3.
Một số điểm chú ý khi
làm bài tập về phản ứng nhiệt luyện
a.
Khi dùng CO để khử Fe2O3
+ Nếu CO dư, phản ứng
hoàn toàn : Fe2O3+ CO
+ Nếu phản ứng không
hoàn toàn: CO sẽ khử dần oxit sắt qua 3 giai đoạn:

ð Chất rắn thu được có tối đa là 4 chất ( Fe và 3 oxit)
b.
khí than ướt : là khí
thu được sau khi cho hơi nước đi qua than nung đỏ, luôn có phản ứng:
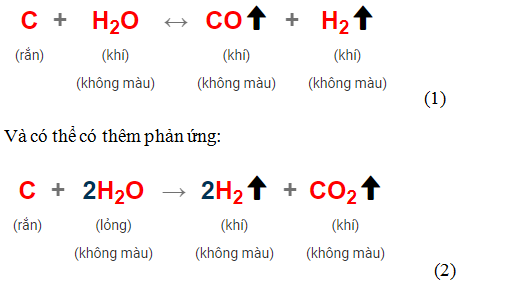
Khí thu được có CO, H2,
H2O và có thể có CO2.
-
Cần dựa vào đặc điểm
thành phần khí thu được để xem có phản ứng
(2) xảy ra hay không
- Bảo toàn e: 2nCO + 4nCO2 = 2nH2
c. Khí than khô (khí lò ga):
- là hỗn hợp khí thu được khi cho không khí đi qua
than nung đỏ
Hỗn hợp khí thu được có CO, CO2, N2,
O2.
d. phương pháp làm bài:
Bảo toàn Khối lượng
mCrgiam =mcr ban dau – mCr sau = mOmat
nO mat = nO
phan ung = nCO2 sinhra= nH2phanung= nH2O sinh
ra
III.
Phương pháp điện
phân:
1.
Khái niệm:
-
Dùng dòng điện 1 chiều
để khử ion kim loại trên katot (cực âm)thành kim loại
·
Cấu tạo của bình điện
phân:
-
1 bình đựng hóa chất
cần điện phân
-
Có 2 điện cực
+ K (-) làm bằng than chì, graphit, Pt ( điện cực trơ)
+ A (+) làm bằng 1 kim loại khác Pt ( điện cực không
trơ)
-
Nguồn điện 1 chiều: cực
âm của nguồn điện nối với katot bình điện phân, cực dương có nguồn điện nối với
anot bình điện phân.
·
Cơ chế hoạt động của
bình điện phân:
-
Dưới tác dụng của
dòng điện 1 chiều, các ion chất điện phân sẽ di chuyển về các điện cực.
+ cation về K ( ion dương về cực âm)
+ anion về A ( ion âm về cực dương)
-
Tại các điện cực xảy
ra quá trình oxh khử
+ tại K : xảy ra quá trình oxh
+ tại A : xảy ra quá trình khử
2.
Phạm vi áp dụng:
-
Điều chế hầu hết các
kim loại từ TB -> yếu tuy nhiên căn cứ vào mức độ hoạt động của kim loại để
áp dụng pp điện phân phù hợp
a.
Điện phân nóng chảy:
·
Chất điện phân ở trạng
thái lỏng ( do nóng chảy) : thường là oxit kim loại, hidroxit kim loại, muối
halogenua
·
Pp này điều chế được
tất cả các kim loại nhưng tiêu tốn điện năng(vì phải dùng điện năng để chuyển
thành kim loại ) nên trong thực tế chỉ áp dụng để điều chế những kim loại có
tính khử mạnh ( IA, IIA và Al)
IA : đpnc muối halogen hoặc hidroxit
IIA. Đpnc muối Halogen
Al : đpnc Al2O3
·
Trong quá trình dpnc
trộn thêm bột criolit Na3AlF6 vào nhằm các mục đích:
-
Giảm nhiệt độ nóng chảy
của chất điện phân => tiết kiệm năng lượng
-
Tạo ra hỗn hợp có khả
năng dẫn điện tốt hơn => tăng hiệu suất điện phân
-
Tạo ra lớp xỉ mỏng nổi
trên bề mặt kim loại nguyên chất ngăn cản không cho kim loại nguyên chất tiếp
xúc với không khí
b.
Điện phân dung dịch:
·
Chất điện phân là
dung dịch muối
·
Phạm vi áp dụng:
phương pháp điện phân dung dịch muối chỉ được áp dụng để điều chế những kim loại
có tính khử từ TB -> yếu đứng sau Al.
·
Thứ tự điện phân tại
K (-)
-
Tại K luôn có H2O
, cation kim loại (Rn+) và có thể có H+ của axit
+ Tạo ra quá trình khử theo thứ tự: tiểu phân nào có
tính oxh mạnh hơn sẽ bị khử trước.
Chú ý: các ion kim loại IA, IIA, Al không bị điện phân
trong dd mà H2O sẽ điện phân thay thế tạo thành phân tử bazo trong
phương trình điện phân
-
Tại A luôn có: H2O,
anion gốc axit, và có thể có OH- của bazo xảy ra quá trình oxh các
tiểu phân theo thứ tự : tiểu phân nào có tính khử mạnh hơn sẽ bị oxh trước.
c.
Chú ý khi làm bài tập
điện phân:
-
Nhớ thứ tự điện phân ở
các điện cực
-
Tùy vào yêu cầu bài
toán
+ viết pt điện phân: với những bài tập cần làm việc với
dung dịch sau điện phân
+ chỉ viết quá trình ở điện cực khi chỉ cần tính toán ở
điện cực
-
Có thể áp dụng Định
luật bảo toàn e
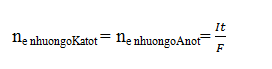
I : cường độ dòng điện (A)
t : thời gian điện phân ( s)
F= 96500
-
Định luật Faraday
dùng để tính khối lượng kim loại hoặc chất khí thoát ra ở điện cực
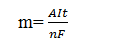
A: khối lượng mol của chất thoát ra
n : số e trao đổi của chất thoát ra
Phần 2. Ví dụ mẫu
Câu 1: Điện phân (với điện cực Pt) 200ml dd Cu(NO3)2 đến khi bắt đầu có khí thoát ra ở catot thì ngừng lại. Để yên dd cho đến khi khối lượng catot không đổi, lúc đó khối lượng catot tăng thêm 3,2g so với lúc chưa điện phân. Nồng độ mol của dd Cu(NO3)2 trước phản ứng là:
A. 0,5M B. 0,9M C. 1M D. 1,5M
Hướng dẫn giải:

|
| ||

Hướng dẫn giải:
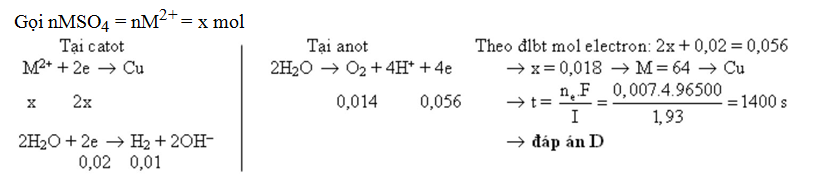
Phần 2. Bài tập vận dụng:
Câu 1. Cho luồng khí
H2 (dư) qua hỗn hợp các oxit CuO, Al2O3, ZnO,
Fe3O4, MgO nung ở nhiệt độ cao. Sau phản ứng hỗn hợp rắn
còn lại chứa số oxit kim loại là
A. 1. B. 2. C. 3. D. 4.
A. Na, Ca,
Al. B. Na, Ca, Zn. C. Na, Cu, Al. D. Fe, Ca, Al.
Câu 3. Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung
dịch muối (với điện cực trơ) là
A. Ni, Cu, Ag. B. Li,
Ag, Sn. C. Ca, Zn, Cu. D. Al, Fe, Cr.
Câu 4Phương pháp chung để điều chế các
kim loại Na, Ca, Al trong công nghiệp là
A. điện phân dung dịch. B. nhiệt luyện. C. thủy luyện. D. điện phân nóng chảy.
Câu 5 Trong công nghiệp, Mg được điều
chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2. B. Điện
phân dung dịch MgSO4.
C. Cho kim loại K vào dung dịch Mg(NO3)2. D. Cho
kim loại Fe vào dung dịch MgCl2.
Câu 6. Kim loại nào sau đây điều chế được
bằng phương pháp thủy luyện ?
A. Ca. B.
K. C. Mg. D. Cu.
Câu 7. Hai kim loại có thể được điều chế
bằng phương pháp điện phân dung dịch là
A. Al và Mg. B. Na và Fe. C. Cu
và Ag. D. Mg và Zn.
Câu 8. Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung
dịch muối của chúng là:
A. Fe, Cu, Ag. B. Mg,
Zn, Cu. C.
Al, Fe, Cr. D. Ba, Ag, Au.
Câu 9. Khi điện
phân NaCl nóng chảy (điệncực trơ), tại catot xảy ra
A. sự oxi hoá ion Cl- B. sự
oxi hoá ion Na+. C. sự
khử ion Cl-. D.
sự khử ion Na+.
A. Cu2+, Ag+, Pb2+, Zn2+. B. Pb2+, Ag+, Cu2+, Zn2+.
C. Zn2+, Pb2+, Cu2+, Ag+. D. Ag+, Cu2+, Pb2+, Zn2+
Câu 11:Điện phân (điện cực trơ, có vách ngăn) một dung dịch có chứa các ion: Fe2+,
Fe3+, Cu2+. Thứ tự các cation bị khử ở catot lần lượt là
A. Fe3+, Cu2+, Fe2+. B. Cu2+, Fe3+, Fe2+. C.
Fe3+, Fe2+, Cu2+. D. Fe2+,
Fe3+, Cu2+.
Câu 12:Một dung dịch
X chứa đồng thời NaNO3, Cu(NO3)2, Fe(NO3)3,
Zn(NO3)2, AgNO3. Thứ tự các kim loại thoát ra
ở catot khi điện phân dung dịch trên là
A. Ag, Fe, Cu, Zn, Na B. Ag, Fe, Cu, Zn
C. Ag, Cu, Fe,
Zn D. Ag, Cu, Fe, Zn, Na
Câu 13 :Điện phân
dung dịch X chứa hỗn hợp các muối sau: CaCl2, FeCl3, ZnCl2,
CuCl2. Ion đầu tiên bị khử ở catot là
A. Cl-. B. Fe3+. C. Zn2+. D. Cu2+.
Câu 14 :Điện phân dung dịch X chứa hỗn hợp các muối sau: CaCl2, FeCl3,
ZnCl2, CuCl2. Kim loại đầu tiên thoát ra ở catot là
A. Ca. B. Fe. C. Zn D. Cu.
Câu 15. Điện phân dung dịch X chứa hỗn hợp các muối sau: NaCl, CuCl2,
FeCl3, ZnCl2. Kim loại cuối cùng thoát ra ở catot trước
khi có khí thoát ra là
A. Fe. B. Cu. C. Na. D. Zn.
Câu 16. Hai chất đều không khử được sắt oxit (ở nhiệt độ
cao) là
A. Al, Cu. B. Al,
CO. C. CO2 , Cu. D. H2
, C.
A. Al, Fe, Cu. B. Zn, Mg, Pb. C. Ni,
Cu, Ca. D. Fe, Cu, Ni.
Câu 18. Phương pháp điều chế kim loại bằng cách dùng đơn chất kim loại có tính khử
mạnh hơn để khử ion kim loại khác trong dung dịch muối được gọi là :
A. phương pháp nhiệt luyện. B. phương pháp thủy luyện.
C. phương pháp điện phân. D. phương pháp thủy phân.
Câu 19. Phương pháp nhiệt nhôm dùng để điều
chế kim loại:
A. Dùng điều chế các kim loại đứng sau H. B. Dùng điều chế các kim loại đứng sau Al.
C. Dùng điều chế các kim loại dể nóng chảy. D. Dùng điều chế các kim loại khó nóng chảy.
Câu 20. Những kim loại nào có thể điều chế bằng phương pháp nhiệt
luyện ?
A. Kim loại có tính khử mạnh như Na, K, Ca… B. Kim loại có tính khử trung bình như
Zn, Fe, Sn…
C. Các kim loại như Al, Zn, Fe… D. Các kim loại như Hg, Ag, Cu…
Câu 21. Trong công nghiệp, các kim loại quý như Ag, Au được điều chế chủ yếu bằng
phương pháp
A. thủy luyện. B. nhiệt luyện. C. điện phân nóng chảy. D. điện
phân dung dịch.
Câu
22. Từ Mg(OH)2 người ta điều chế Mg bằng cách nào trong các cách
sau:
(1)
(2)
Hoà tan Mg(OH)2 vào
dung dịch HCl sau đó điện phân dung dịch MgCl2 có màng ngăn.
(3)
Nhiệt phân Mg(OH)2 sau
đó khử MgO bằng CO hoặc H2 ở nhiệt độ cao
(4)
Hoà tan Mg(OH)2 vào dung dịch HCl, cô cạn dung
dịch sau đó điện phân MgCl2 nóng chảy Cách làm đúng là
A. 1 và 4. B. Chỉ có 4. C. 1, 3 và 4. D. Cả 1, 2, 3 và 4.
Câu 23. Để điều chế K kim loại người ta có thể dùng các phương pháp sau:
(1). Điện phân dung dịch KCl có vách ngăn xốp.
(2).
Điện phân KCl nóng chảy.
(3).
Dùng i để khử K ra khỏi ddKCl (4). Dùng CO để khử K ra khỏi
K2O. (5). Điện phân nóng chảy
KOH
Chọn phương pháp thích hợp
A. Chỉ có 1, 2. B. Chỉ có 2, 5.
C. Chỉ có 3, 4, 5. D. 1, 2, 3, 4, 5.
Câu 24. Tiến hành các thí nghiệm sau:
(a)
Cho Mg vào dung dịch Fe2(SO4)3 dư;
(b)
Dẫn khí H2 (dư) qua bột
MgO nung nóng;
(c)
Cho dung dịch AgNO3
tác dụng với dung dịch Fe(NO3)2 dư;
(d)
Cho Na vào dung dịch MgSO4;
(e)
Nhiệt phân Hg(NO3)2;
(g) Đốt Ag2S trong không khí;
(h). Điện
phân dung dịch Cu(NO3)2 với các điện cực trơ. Số thí
nghiệm không tạo thành kim loại là
A. 3. B.
4. C. 2. D. 5.
Câu 25:Trong quá
trình điện phân dung dịch KBr, phản ứng nào sau đây xảy ra ở anot?
A. Ion Br- bị oxi hóa. B. Ion
Br- bị khử. C. Phân tử H2O bị khử. D. Ion
K+ bị oxi
hóa.
Câu 26:Có 4 dung
dịch muối: AgNO3, KNO3, CuCl2, ZnCl2.
Khi điện phân (với điện cực trơ) dung dịch muối nào thì có khí thoát
ra ở cả anot và catot?
A. ZnCl2. B. KNO3. C. CuCl2. D. AgNO3.
Câu 27:Cho các chất sau: CuCl2; AgNO3; MgSO4;
NaOH; CaCl2; H2SO4; Al2O3.
Trong thực tế, số chất có thể vừa điện phân nóng chảy, vừa điện phân dung dịch
là
A. 3 B. 1 C. 4 D. 2
Câu 28:Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện
phân hợp chất nóng chảy của chúng là
A. Na, Ca, Zn B. Na,
Cu, Al C. Na, Ca, Al D.
Fe, Ca, Al
Câu 29:Hai kimloại có thể được điều chế bằng phương pháp điện phân dung dịch là
A. Al và Mg. B. Na và Fe. C. Cu
và Ag. D. Mg và Zn.
(Trích đề thi tuyển sinh Cao đẳng
– 2008)
Câu 30:Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung
dịch muối của chúng là
A. Fe, Cu, Ag. B. Mg, Zn, Cu. C. Al, Fe, Cr. D.
Ba, Ag, Au.
Câu 31. Dãy kim loại đều được điều chế bằng điện phân dung dịch.
A. Al, Fe, Cu, Ag B. Ba, Mg, Fe, Cu C. Fe, Ni, Cu, Ag D.
Na, Fe, Ni, Cu
Câu 32. Dùng phương pháp điện phân dung dịch có thể điều chế được tất cả các kim
loại nào sau.
A. Na; Mg; Li; Al. B. Cr; Sn; Mg; Ag. C. Ag; Fe; Cu; Al. D. Cu; Ni; Ag; Zn
|
4 |
A.b > 2a. B.b
= 2a. C.b < 2a. D.2b =
a
Câu 34. Điện phân dung dịch chứa x mol NaCl và y mol CuSO4 với điện cực
trơ, màng ngăn xốp đến khí nước bị điện phân ở 2 điện cực thì ngừng. Thể tích
khí ở anot sinh ra gấp 1,5 lần thể tích khí ở catot ở cùng điều kiện nhiệt độ
và áp suất. Quan hệ giữa x và y là
A. x = 3y B. y = 1,5x C.
x =1,5y D. x = 6y
Câu 35:Khi điện phân
dung dịch NaCl (điện cực trơ, không có vách ngăn) thì sản phẩm thu được gồm:
A. H2, nước Ja-ven B. H2, Cl2, NaOH,
nước Ja-ven
C. H2, Cl2, nước Ja-ven D. H2, Cl2, NaOH
Câu 36: Trong công
nghiệp để sản xuất clo người ta:
A.
cho
dung dịch HCl tác dụng với chất oxi hóa mạnh như KMnO4, KClO3...
B.
điện
phân dung dịch HCl.
C.
điện
phân có màng ngăn dung dịch NaCl bão hòa.
D.
điện
phân không màng ngăn dung dịch NaCl bão hòa.
Câu 37: Thể tích khí hiđro sinh ra khi điện phân dung dịch chứa cùng một lượng NaCl
có màng ngăn (1) và không có màng ngăn (2) là
A. bằng nhau B. (2) gấp đôi (1) C. (1)
gấp đôi (2) D. không xác định
Câu 38:Khi điện phân dung dịch CuCl2 (điện cực trơ), nồng độ của CuCl2
trong quá trình điện phân
A. Không đổi B. Tăng dần C. Giảm dần D. Tăng sau đó giảm Câu 39:Khi điện phân dung dịch NaNO3
với điện cực trơ thì nồng độ của dung dịch NaNO3 trong quá trình
điện phân
A. Không đổi B. Tăng dần C. Giảm dần D. Tăng sau đó giảm Câu 40:Khi điện phân có vách ngăn dung
dịch gồm NaCl, HCl. Sau một thời gian điện phân xảy ra hiện tượng nào dưới đây?
A.
Dung
dịch thu được có làm quỳ tím hóa đỏ
B.
Dung
dịch thu được không đổi màu quỳ tím
C.
Dung
dịch thu được làm xanh quỳ tím
D.
A,
B, C đều có thể đúng
Câu 41:Điện phân (có màng ngăn, điện cực trơ) một dung dịch chứa hỗn hợp CuSO4
và NaCl. Dung dịch sau điện phân có thể hoà tan bột Al2O3.
Dung dịch sau điện phân có thể chứa
A. H2SO4 hoặc NaOH B. NaOH
C. H2SO4 D. H2O
Câu 42:Hòa tan hết hai kim loại X, Y trong dung dịch HCl dư, thêm tiếp vào đó
lượng dư dung dịch NH3. Lọc lấy kết tủa, nhiệt phân kết tủa, rồi
điện phân nóng chảy chất rắn thì được kim loại X. Thêm H2SO4
vừa đủ vào dung dịch nước lọc, rồi điện phân dung dịch thu được, thì sinh ra
kim loại Y. Cặp kim loại X, Y có thể là
A. Al, Cu. B. Fe,
Zn. C. Al, Zn. D. Al, Mg.
Câu 43:Khi điện phân với điện cực trơ dung dịch chứa hỗn hợp FeCl3,
CuCl2 và HCl đến khi khối lượng catot không đổi thì tại anot
A.
chỉ
có H2O nhường electron.
B.
chỉ
có Cl− nhường electron.
C.
H2O
và Cl− đồng thời nhường electron.
D.
Cl−
nhường electron trước, H2O nhường electron sau.
Câu 44. Natri, canxi, magie, nhôm được sản
xuất trong công nghiệp bằng phương pháp nào?
A. Phương pháp
thuỷ luyện B. Phương pháp nhiệt luyện
C. Phương pháp
điện phân D. Phương pháp điện phân hợp chất nóng chảy
Câu 45. Trong công
nghiệp, natri hiđroxit được sản xuất bằng phương pháp
A.
điện phân dung dịchNaNO3, không có màng ngăn điện cực.
B.
điện
phân dung dịch NaCl, có màng ngăn điện cực.
C.
điện
phân dung dịch NaCl, không có màng ngăn điện
cực.
D.
điện
phân NaCl nóng chảy.
(Trích đề thi tuyển sinh Cao đẳng
– 2007)
Câu 46.. Trong công nghiệp, natri hydroxit (NaOH) được điều chế bằng cách.
A.
Cho
dung dịch Ba(OH)2 vào dung dịch Na2SO4.
B.
Cho
Na vào nước dư.
C.
Điện
phân dung dịch NaCl có màng ngăn.
D.
Điện
phân dung dịch NaCl không có màng ngăn.
Câu 47: Từ dung dịch Na2CO3 ta có thể điều chế Na bằng cách
A.
Cô
cạn dung dịch rồi điện phân Na2CO3 nóng chảy.
B.
Chuyển
dung dịch Na2CO3 thành dung dịch NaCl, cô cạn rồi điện
phân nóng chảy NaCl
C.
Chuyển
dung dịch Na2CO3 thành dung dịch NaCl, rồi điện phân dung
dịch NaCl
D.
Điện
phân dung dịch Na2CO3
.
Câu 48. Sản phẩm thu được khi điện phân NaOH nóng chảy là gì ?
A.
Ở
catot (-): Na và ở anot (+): O2 và
H2O.
B.
Ở
catot (-): Na2O và ở anot (+): O2 và H2.
C.
Ở
catot (-): Na và ở anot (+): O2 và
H2.
D.
Ở
catot (-): Na2O và ở anot (+): O2 và H2O.
Câu 49.:Trong phòng thí nghiệm, người ta thườngđiều chế clo bằng cách
A.
điện
phân nóng chảy NaCl.
B.
cho
dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C.
điện
phân dung dịch NaCl có màng ngăn.
D.
cho
F2đẩy Cl2ra khỏi dung dịchNaCl.
(Trích đề thi tuyển sinh ĐH – CĐ
khối A – 2007)
Câu 50. Phát biểu nào sau đây không đúng?
A.
Tính
chất hoá học chung của kim loại là tính khử.
B.
Nguyên
tắc làm mềm nước cứng là làm giảm nồng độ ion Ca2+, Mg2+
C.
Có
thể điều chế nhôm bằng cách điện phân nóng chảyAlCl3.
D.
Trong
các hợp chất, nguyên tố kim loại kiềm thổ chỉ có số oxi hóa là +2.
Câu 51:Thực hiện các
thí nghiệmsau:
(I)
Cho dung dịch NaCl vào dung dịch KOH.
(II)
Cho dung dịch Na2CO3vào
dung dịch Ca(OH)2.
(III)
Điện phân dung dịch NaCl vớiđiện
cực trơ, có màng ngăn.
(IV)
Cho Cu(OH)2vào dung dịch NaNO3.
(V)
SụckhíNH3 vào dung dịch
Na2CO3.
(VI)
Cho dung dịch Na2SO4vào dung dịch
Ba(OH)2. Các thí nghiệmđều điều chế được NaOH là
A.
II,
III và VI. B. I,
II và III. C.
I, IV và V. D. II, V và VI.
(Trích đề thi tuyển sinh ĐH – CĐ
khối B – 2009)
Câu 52. Thực hiện các thí nghiệm sau:
(1)
Cho bột Fe vào dung dịch CuCl2.
(2)
Điện phân dung dịch CuSO4
bằng điện cực trơ.
(3)
Điện phân nóng chảy Al2O3.
(4)
Nung nóng hỗn hợp gồm Al và Fe2O3
(tỉ lệ mol 2 : 1)
(5)
Thổi luồng khí CO đến dư qua ống
sứ chứa CuO.
(6)
Cho Na vào dung dịch CuSO4.
Sau khi kết thúc thí
nghiệm, số trường hợp thu được đơn chất là.
A. 6 B. 4 C. 5 D. 3
Câu 53: Cho các phát biểu sau:
(a)
Các
kim loại kiềm đều tan tốt trong nước.
(b)
Các kim loại Mg, Fe, K và Al chỉ
điều chế được bằng phương pháp điện phân nóng
chảy,
(c)
Các kim loại Mg, K và Fe đều khử
được ion Ag+ trong dd thành Ag.
(d)
Khi cho Mg vào dd FeCl3 dư thu được kim loại Fe.
Số phát biểu đúng là
A. 2. B. 4. C. 1. D. 3.
Câu 54:Trong các quá trình sau đây ion Na+ thể hiện tính oxi hóa hay
tính khử?
1.
Điện phân NaOH nóng chảy.
2.
Điện phân dung dịch NaOH có màng ngăn.
3.
Nhiệt phân NaHCO3 ở
nhiệt độ cao.
A.
1
và 2 thể hiện tính oxi hóa; 3 thể hiện tính
khử.
B.
1
thể hiện tính oxi hóa; 2, 3 thể hiện tính khử.
C.
1
thể hiện tính oxi hóa; 2, 3 không thể hiện tính oxi hóa và khử.
D.
1,
2, 3 đều thể hiện tính oxi hóa.
Câu 55: Khi điện phân nóng chảy NaOH, các phản ứng nào đúng trong các phản ứng sau
1) catot: Na – 1e →Na+
2) anot: 2OH- - 2e → O2
+ 2H+
3)
anot: 4OH- -4e → O2
+ 2H2O
4)
catot: Na+ + 1e → Na
5)
Phương trình điện phân: 4NaOH →
Na+ + O2 + H2O
6)
Phương trình điện phân: 4NaOH →
4Na + O2 + 2H2O
A.3, 4, 6. B. 1, 2, 6. C. 1, 3, 5. D. 3, 4, 5.
Câu 56:Trong quá trình sản xuất Al bằng cách điện phân Al2O3
nóng chảy, criolit có vai trò như sau:
(1)Criolit được cho vào để hạ nhiệt
độ nóng chảy của hỗn hợp, từ đó tiết kiệm năng lượng. (2)Criolit nóng chảy hoà
tan Al2O3 tạo ra chất lỏng có tính dẫn điện tốt hơn Al2O3
nóng chảy. (3)Criolit nóng hoà tan Al2O3 tạo điều kiện
cho Al2O3 dễ dàng tác dụng trực tiếp với C (của điện cực)
tạo thành Al nóng chảy.
(4)Al2O3 tan trong criolit nóng chảy tạo ra hỗn hợp
có khối lượng riêng nhẹ hơn Al nổi lên trên và bảo vệ Al nóng chảy không bị oxi
hoá bởi O2 không khí.
A. 1, 3, 4. B. 1, 2 ,3. C. 2, 3, 4. D. 1, 2, 4.
Câu 57. Người ta dự kiến điều chế oxi theo các quá
trình dưới đây:
1)
Điện
phân H2O.
2)
Phân
hủy H2O2 với chất xúc tác MnO2.
3)
Điện
phân dung dịch CuSO4.
4)
Chưng
cất phân đoạn không khí lỏng.
5)
Điện
phân dung dịch NaOH.
6)
Nhiệt
phân KClO3 với xúc tác MnO2.
Số quá trình thường áp
dụng để điều chế O2 trong phòng thí nghiệm là
A. 3. B. 2. C. 4. D. 5.
Câu 58:Cho các phát biểu sau:
1.
Hỗn hợp CaF2 và H2SO4
đặc ăn mòn được thủy tinh
2.
Điện phân dung dịch hỗn hợp KCl
và HCl thu được khí Cl2 ở anot.
3.
Amophot là hỗn hợp gồm (NH4)2HPO4 và (NH4)3PO4
thu được khí cho NH3 tác dụng với H3PO4.
4.
Trong công nghiệp người ta sản xuất
nước Giaven bằng cách điện phân dung dịch NaCl có màng ngăn.
5.
Đi từ flo đến iot nhiệt độ nóng chảy và nhiệt độ sôi của
các halogen giảm dần. Số phát biểu đúng là :
A. 2 B. 5 C. 4 D. 3
Câu 59: Trong các phát biểu sau :
(1)
Theo chiều tăng dần điện tích hạt nhân, các kim loại kiềm
thổ (từ Be đến Ba) có nhiệt độ nóng chảy giảm
dần.
(2)
Kim loại Mg có kiểu mạng tinh thể
lập phương tâm diện.
(3)
Các kim loại Na, Ba, Be đều tác dụng
với nước ở nhiệt độ thường.
(4)
Kim loại Mg tác dụng với hơi nước
ở nhiệt độ cao.
(5)
Trong công nghiệp, kim loại Al được
điều chế bằng phương pháp điện phân Al2O3 nóng chảy.
(6)
Kim loại Al tan được trong dung dịch HNO3 đặc,
nguội. Số phát biểu đúng là
A. 3 B. 4 C. 5. D. 2
Câu60: Điện phân 1
muối clorua kim loại kiềm nóng chảy thu được 0,896 lít Cl2 (đkc) ở
anot và 3,12 gam kim loại ở catot. Công thức muốiđó là:
A. NaCl. B. KCl. C. LiCl. D. RbCl.
Câu 61: Điện phân muối clorua kim loại ở trạng thái nóng chảy, sau thời gian ta
thấy ở catot có 2,74 gam kim loại và ở anot có 448 ml khí (đktc). Công thức
muối clorua là:
A. CaCl2. B. NaCl . C. KCl. D. BaCl2.
Câu 62: Điện phân nóng chảy muối clorua của kim loại M, ở anot thu được 1,568 lit
khí (đktc), khối lượng kim loại thu được ở catot là 2,8 gam. Kim loại M là:
A. Mg. B. Na. C. K. D. Ca.
|
Câu 63: Điện
phân hòa toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được
448 ml khí (ở đktc) ở anot. Kim loại trong muối là: A. Na B. Ca C. K D. Mg |
Câu
63: Điện phân hòa
toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được 448 ml khí (ở
đktc) ở anot. Kim loại trong muối là:
Câu 64: Cho dòng điện một chiều có cường độ 16A đi qua nhôm oxit nóng chảy trong 3
giờ. Khối lượng Al
thoát ra ở catot là:
A. 8,0 gam. B. 91,3
gam. C. 46,0 gam. D.
16,1 gam.
Câu 65: Khi điện phân 25,98 gam iotua của một kim loại X nóng chảy, thì thu được
12,69 gam iot. Cho biết công thức muối iotua
A.NaI B. KI C.MgI2 D.CsI
Câu 66: Điện phân nóng chảy Al2O3 với anot than chì (hiệu
suất điện phân 100%) thu được m kg Al ở catot và 67,2 m3 (ở đktc)
hỗn hợp khí X có tỉ khối so với hiđro bằng 16. Lấy 2,24 lít (ở đktc) hỗn hợp
khí X sục vào dung dịch nước vôi trong (dư) thu được 2 gam kết tủa. Giá trị của
m là:
A. 108,0. B. 75,6. C. 54,0. D. 67,5.
(Trích đề thi tuyển sinh ĐH – CĐ
khối B – 2009)
Câu 67: Điện phân nóng chảy Al2O3 với các điện cực bằng than
chì thu được m kg Al ở catot và 89,6 m3 (ở đktc) hỗn hợp khí X ở
anot. Tỉ khối của X so với hiđro bằng 16,7. Cho 1,12 lít X (đktc) phản ứng với
dung dịch Ca(OH)2 (dư) thu được 1,5 gam kết tủa. Biết các phản ứng
xảy ra hoàn toàn. Giá trị của m là
A. 115,2 B. 82,8 C. 114,0 D. 104,4
(Trích đề thi tuyển sinh ĐH – CĐ
khối B – 2013))
Câu 68: Hoà tan 1,28
gam CuSO4 vào nước rồi đem điện phân tới hoàn toàn, sau một thời
gian thu được 800 ml dung dịch có pH = 2. Hiệu suất của phản ứng điện phân là:
A. 62,5%. B. 50% . C. 75%. D. 80%.
Câu 69: Điện phân 200 ml dung dịch CuSO4 nồng độ a mol/l đến khi dung
dịch vẫn còn màu xanh thấy khối lượng dung dịch giảm 8 gam. Cho 16,8 gam Fe vào
dung dịch thu được sau điện phân, sau khi phản ứng xảy ra hoàn toàn thu được
12,4 gam kim loại. Giá trị a là:
A. 2M. B. 1,25M. C. 1,5M. D. 2,5M.
Câu 70: Sau khi điện phân 200 ml dung dịch CuSO4 (d = 1,25 g/ml), khối
lượng dung dịch giảm đi 8 gam. Mặt khác, để làm kết tủa hết lượng CuSO4
chưa bị điện phân phải dùng hết 1,12 lít H2S (đktc). Nồng độ % và
nồng độ mol của dung dịch CuSO4 trước khi điện phân là:
A. 9,6% và 0,75M. B. 16%
và 0,75M. C.
19,2% và 0,75M. D. 9,6% và 0,50M.
Câu 71: Điện phân 200 ml dung dịch Cu(NO3)2 đến khi bắt đầu
có khí thoát ra ở catot thì ngừng. Để yên dung dịch cho đến khi khối lượng không
đổi (tạo khí NO là sản phẩm khử duy nhất) thì khối lượng catot tăng 3,2 gam so
với lúc chưa điện phân. Nồng độ mol/l của dung dịch Cu(NO3)2
trước phản ứng là
A. 0,5M. B. 0,9M. C. 1M. D. 1,5M.
Câu 72: Điện phân 1 lit dung dịch Cu(NO3)2 0,2M đến khi ở
catot bắt đầu có khí thoát ra thì dừng lại, thu được dung dịch A. Dung dịch A
có thể hòa tan được tối đa bao nhiêu gam Fe? ( biết rằng
có khí NO duy nhất thoát ra ngoài)
A. 8,4 gam. B. 4,8 gam. C. 5,6
gam. D. 11,2 gam.
Câu 73: Khi điện phân dung dịch canxi clorua, ở catot thoát ra 4 gam hiđro và V lit
khí thoát ra ở anot. Khối lượng khí thoát ra
là:
A. 32 gam. B. 142
gam . C. 19 gam. D. 64 gam.
Câu 74: Điện phân có màng ngăn hai điện cực trơ 2 Lít dung dịch chứa 0,2 mol CuCl2
và 0,4 mol BaCl2 đến khi được
dd có pH= 13 thì ngưng điện phân. Xem thể tích dd không đổi. Tính thể tích khí
lần lượt thoát ra ở catot và anot?
A. 6,72 và 2,24 lít B. 2,24 và 6,72 lít C. 4,48 và 2,24 lít D. 2,24 và 4,48 lít
Câu 75: Tiến hành điện phân có màng ngăn, hai điện cực trơ 500ml dd hỗn hợp HCl
0,02M và NaCl 0,2 M. Sau khi ở anot thoát ra 0,448 lít khí ( đktc) thì ngừng
điện phân. Giả sử thể tích dung dịch không đổi, pH của dd sau điện phân là:
A. 1,7 B. 1,22 C. 12,78 D. 12,3
Câu 76: Điện phân
dung dịch NaOH với cường độ dòng điện là 10A trong thời gian 268 giờ. Sau khi
điện phân còn lại 100 gam dung dịch NaOH có nồng độ 24%. Nồng độ % của dung
dịch NaOH trước khi điện phân là:
A. 4,2%. B. 2,4%. C. 1,4%. D. 4,8%.
Câu 77: Người ta điều chế H2 và O2 bằng phương pháp điện phân
dung dịch NaOH với điện cực trơ, cường độ dòng điện 0,67 A trong thời gian 40
giờ. Dung dịch thu được sau điện phân có khối
lượng 100 gam và nồng độ NaOH là 6%. Nồng độ dung dịch NaOH trước điện phân là
(giả thiết lượng nước bay hơi không đáng kể)
A. 5,08% B. 6,00% C. 5,50% D. 3,16%
(Trích đề thi tuyển sinh ĐH – CĐ
khối B – 2012)
Câu 78: Điện phân
(dùng điện cực trơ) dung dịch muối sunfat của kim loại hoá trị II với cường độ
dòng điện 3A. Sau 1930 giây thấy khối lượng catot tăng 1,92 gam. Công thức của
muối sunfat đã bị điện phân là:
A. CuSO4. B. FeSO4. C. MgSO4. D.
NiSO4.
Câu79: Điện phân một dung dịch muối nitrat của một kim loại M hóa trị n với cường
độ dòng I = 9,65A, thời gian điện phân 400 giây thì thấy khối lượng catot tăng
4,32 gam. Kim loại M là:
A. Cu. B. Ag. C. Fe. D. Zn.
Câu 80: Điện phân dung dịch một muối nitrat kim loại với hiệu suất 100%, cường độ
dòng điện không đổi 7,72A trong thời gian 9 phút 22,5 giây. Sau khi kết thúc
khối lượng catot tăng lên 4,86 gam do kim loại bám vào. Kim loại đó là:
A. Cu. B. Hg. C. Ag . D.
Pb.
Câu 81. Điện phân dung dịch X chứa 0,4 mol M(NO3)2 và NaNO3
(với điện cực trơ) trong thời gian 48 phút 15 giây, thu được 11,52 gam kimloại
M tại catôt và 2,016 lít khí (đktc) tại anôt.Tên kim loại M và cường độ dòng
điện là
A. Fe và 24A B. Zn
và 12A C. Ni và 24A D.
Cu và 12A
Câu 82: Điện phân (điện cực trơ) dung dịch chứa 0,02 mol NiSO4 với cường
độ dòng điện 5A trong 6 phút 26 giây. Khối lượng catot tăng lên bằng:
A. 0,00 gam. B. 0,16
gam. C. 0,59 gam. D.
1,18 gam.
Câu 83: Hoà tan 40 gam muối CdSO4 bị ẩm vào nước. Để điện phân hết
cađimi trong dung dịch cần dùng dòng điện 2,144A và thời gian 4 giờ. Phần trăm
nước chứa trong muối là:
A. 18,4%. B. 16,8%. C. 18,6%. D. 16%.
Câu 84: Thể tích khí (đktc) thu được khi điện phân hết 0,1 mol NaCl trong dung dịch
với điện cực trơ, màng ngăn xốp là:
A. 0,224 lít. B. 1,120 lít. C.
2,240 lít. D. 4,489 lít.
Câu85: Điện phân 200ml dung dịch Y gồm KCl 0,1M và Cu(NO3)2
0,2M với cường độ dòng điện 5A trong thời gian 1158 giây, điện cực trơ, màng
ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch
sau khi điện phân là
A. 3,59 gam. B. 2,31 gam. C. 1,67
gam. D.
2,95 gam.
Câu 86: Thực hiện
phản ứng điện phân dung dịch chứa mg hỗn hợp CuSO4 và NaCl với cường
độ dòng điện là 5A. Đến thời điểm t, tại 2 điện cực nước bắt đầu điện phân thì
ngắt dòng điện. Dung dịch sau điện phân hoà tan vừa đủ 1,6 gam CuO và ở anot
của bình điện phân có 448 ml khí bay ra (đktc). Khối lượng dung dịch giảm do
phản ứng điện phân là:
A. 3,59 gam. B. 3,15
gam. C. 1,295 gam. D. 2,95
gam.
Câu 87: Thực hiện phản ứng điện phân dung dịch chứa mg hỗn hợp CuSO4 và
NaCl với cường độ dòng điện là 5A. Đến thời điểm t, tại 2 điện cực nước bắt đầu
điện phân thì ngắt dòng điện. Dung dịch sau điện phân hoà tan vừa đủ 1,6 gam
CuO và ở anot của bình điện phân có 448 ml khí bay ra (đktc). Nếu thể tích dung
dịch không thay đổi V = 500 ml thì nồng độ mol của các chất trong dung dịch là:
A. 0,04M; 0,08M. B. 0,12M; 0,04M. C. 0,3M; 0,05M. D. 0,02M; 0,12M.
Câu88: Hòa tan 72
gam hỗn hợp gồm Fe2(SO4)3 và CuSO4
có tỉ lệ mol tương ứng là 2:1 vào bình đựng 0,1 mol H2SO4
loãng thì thu được dung dịch X. Tiến hành điện phân dung dịch X (với điện cực
trơ) với cường độ dòng điện 10A trong thời gian 1 giờ 4 phút 20 giây. Khối
lượng dung dịch sau điện phân giảm bao nhiêu gam so với dung dịch trước điện
phân? (giả sử trong quá trình điện phân nước bay hơi không đáng kể)
A. 3,3gam. B. 3,2 gam. C. 12,0 gam . D.
9,6 gam.
Câu 89: Điện phân một dung dịch có hoà tan 13,5 gam CuCl2 và 14,9 gam KCl (có màng ngăn và điện
cực trơ) trong thời gian 2 giờ với cường độ dòng điện là 5,1A. Dung dịch sau
điện phân được trung hoà vừa đủ bởi V lít dung dịch HCl 1M. Giá trị của V là
A. 0,18. B. 0,5. C. 0,7. D. 0,9.
Câu 90: Điện phân dung dịch gồm 7,45 gam KCl và 28,2 gam Cu(NO3)2
(điện cực trơ, màng ngăn xốp) đến khi khối lượng dung dịch giảm đi 10,75 gam
thì ngừng điện phân (giả thiết lượng nước bay hơi không đáng kể). Tất cả các
chất tan trong dung dịch sau điện phân là:
A. KNO3 và KOH. B. KNO3, HNO3 và Cu(NO3)2.
C. KNO3, KCl và KOH. D. KNO3 và Cu(NO3)2.
(Trích đề thi tuyển sinh ĐH – CĐ
khối A – 2011)
Câu 91: Điện phân 500
ml dung dịch AgNO3 0,1M và Cu(NO3)2 0,2M với
cường độ dòng điện I = 10A và điện cực trơ. Sau thời gian t ta ngắt dòng điện.
Dung dịch sau điện phân được lấy ra ngay để đo nồng độ các chất. Biết hiệu suất
điện phân là 100% và thể tích dung dịch coi như không thay đổi, nồng độ mol ion
H+ là 0,16M. Khối lượng của catot tăng lên là:
A. 0,96 gam. B. 6,36
gam. C. 5,4 gam. D.
3,2 gam.
Câu 92: Điện phân 500 ml dung dịch AgNO3 0,1M và Cu(NO3)2
0,2M với cường độ dòng điện I = 10A và điện cực trơ. Sau thời gian t ta ngắt
dòng điện. Dung dịch sau điện phân được lấy ra ngay để đo nồng độ các chất. Nếu
hiệu suất điện phân là 100% và thể tích dung dịch coi như không thay đổi, nồng
độ mol ion H+ là 0,16M. Nồng độ mol/l của muối nitrat trong dung
dịch sau điện phân là:
A. 0,2M. B. 0,17M. C. 0,15M. D. 0,3M.
Câu 93: Trộn 200 ml dung dịch AgNO3 xM với 250 ml dung dịch Cu(NO3)2
yM được dung dịch A. Lấy 250 ml dung dịch A điện phân với điện cực trơ, I =
0,429A. Sau 5 giờ điện phân thấy khối lượng kim loại thu được là 6,36 gam. Giá trị của x và y lần lượt là:
A. 0,45 và 0,108. B. 0,25 và 0,45. C. 0,108 và 0,25. D. 0,25 và 0,35.
Câu 94: Khi điện phân 1000 gam dung dịch bạc nitrat 5,l%, ở catot thoát ra 10,8 gam
chất rắn. Sau đó cho thêm vào bình điện phân 500 gam dung dịch đồng (II) clorua
13,5% và điện phân cho đến khi ở anot thoát ra 8, 96 lit khí (đktc). Nồng độ %
các chất trong dung dịch cuối cùng là:
A. 1,3% HNO3. B. 1,3% AgNO3. C. 1,3%
Cu(NO3)2. D. 1,3% CuCl2.
Câu 95: Điện phân 200
ml dung dịch CuSO4 0,1M và MgSO4 cho đến khi khí bắt đầu
sủi bọt bên catot thì ngừng điện phân. Khối
lượng kim loại bám lên catot và thể tích khí (đktc) thoát ra ở anot là:
A. 1,28 gam và
0,224 lít. B. 0,64 gam và 0,112 lít .
C. 1,28 gam và
0,112 lít. D. 0,64 gam và 0,224 lít .
Câu 96: Tiến hành
điện phân (có màng ngăn xốp) dung dịch X chứa hỗn hợp gồm 0,02 mol HCl và 0,05
mol NaCl với Cường độ dòng điện là 1,93A trong thời gian 3000 giây, thu được
dung dịch Y. Nếu cho quì tím vào X và Y thì thấy (cho H = 1; Cl = 35,5):
A.
X
làm đỏ quì tím, Y làm xanh quì tím.
B.
X
làm đỏ quì tím, Y làm đỏ quì tím.
C.
X
làm đỏ quì tím, Y không đổi màu quì tím.
D.
X
không đổi màu quì tím, Y làm xanh quì tím.
Câu 97: Điện phân 2 lít dung dịch HCl và KCl trong bình điện phân có màng ngăn, I =
21,23A, sau 15 phút thì dung dịch có pH = 3. pH của dung dịch lúc đầu là:
A. 1. B.
2. C. 3. D. 4.
Câu 98: Điện phân có màng ngăn 500 ml dung dịch chứa hỗn hợp gồm CuCl2
0,1M và NaCl 0,5M (điện cực trơ, hiệu suất điện phân 100%) với cường độ dòng
điện 5A trong 3860 giây. Dung dịch thu được sau điện phân có khả năng hoà tan m
gam Al. Giá trị lớn nhất của m là:
A. 4,05. B. 2,70. C. 1,35. D. 5,40.
(Trích đề thi tuyển sinh ĐH – CĐ
khối B – 2009)
Câu 99: Điện phân dung dịch có hòa tan 10,16 gam FeCl2 và 3,51 gam NaCl
( có màng ngăn và điện cực trơ) trong thời gian 33 phút 20 giây với cường độ
dòng điện I = 9,65A. Dung dịch sau điện phân trung hòa vừa đủ V lit dung dịch
HCl 0,2M. Giá trị của V là:
A. 0,18. B. 0,2. C. 0,3. D. 0,5.
Câu 100: Điện phân 500 ml dung dịch gồm CuCl2 0,1M; FeCl3
0,1M; HCl 0,1M rồi điện phân bằng điện cực trơ với cường độ dòng điện I = 9,65A
trong thời gian 41 phút 40 giây (hiệu suất quá trình điện phân là 100%). Khối
lượng các chất thoát ra ở catot và thể tích khí thoát ra tại anot (đktc) là:
A. 4,65 gam;
2,8 lít. B. 5,45 gam; 2,24 lít.
C. 5,32 gam;
4,48 lít. D. 4,56 gam; 11,2 lít
Phần 3. Đáp án:
|
1. B |
2. A |
3. A |
4. D |
5.A |
6.D |
7.C |
|
8.A |
9. D |
10. D |
11. A |
12. C |
13. B |
14. D |
|
15. D |
16. D |
17. D |
18. B |
19.B |
20.B |
21.A |
|
22.B |
23.B |
24. A |
25. A |
26.B |
27. A |
28.C |
|
29.C |
30.A |
31.C |
32.D |
33.A |
34.D |
35.A |
|
36.C |
37.A |
38.C |
39.B |
40.D |
41.A |
42.C |
|
43.B |
44.D |
45.B |
46.C |
47.B |
48A. |
49.B |
|
50.C |
51.A |
52.A |
53.C |
54.C |
55.A |
56.D |
|
57.B |
58.A |
59. D |
60.B |
61.D |
62.D |
63. B |
|
64.D |
65.D |
66.B |
67.D |
68.B |
69.B |
70.D |
|
71.C |
72.A |
73.B |
74.B |
75.C |
76.B |
77.C |
|
78.A |
79.B |
80.C |
81.D |
82.C |
83.B |
84.C |
|
85.D |
86.D |
87.B |
88.A |
89.A |
90.B |
91.B |
|
92.A |
93.A |
94.C |
95.A |
96.A |
97.A |
98.B |
|
99.B |
100.C |
|
|
|
|
|