Chuyên đề
: Kim loại Kiềm ( nhóm IA)
Phần 1.
Lý thuyết:
I.
Tính chất vật lý, đặc
điểm cấu tạo
1.
Có chung kiểu mạng
tinh thể lập phương tâm khối kém bền nên các kim loại kiềm có độ cứng nhỏ, có
nhiệt độ nóng chảy thấp, có khối lượng riêng nhỏ.
2.
Các quy luật biến đổi
(các đại lượng vật lý)
-
Khối lượng riêng tăng
dần
-
Độ cứng giảm dần
-
Nhiệt độ nóng chảy,
nhiệt độ sôi giảm dần.
II.
Trạng thái tự nhiên:
-
NaCl : muối ăn
-
Diêm tiêu Natri :
NaNO3
-
Xinvinit : KCl.NaCl
-
Criolit: Na3AlF6
III.
Tính chất hóa học : Các nguyên tử kim loại kiềm có năng
lượng ion hóa nhỏ, vì vậy kim loại kiềm có tính khử rất mạnh. Tính khử tăng dần
từ liti đến xesi.
Trong hợp
chất, các kim loại kiềm có số oxi hóa+1.
1. Tác dụng với phi kim
a/ Với O2
2Na
+ O2(khô)→Na2O2
4Na+O2(kk)→2Na2O
b/ Với Cl2
2K
+ Cl2→2KCl
2.
Tác
dụng với axit
2Na+2HCl→2NaCl+H2 ;
2Na+H2SO4→Na2SO4+H2
3.
Tác
dụng với H2O
2K+2H2O→2KOH+H2
Na nóng chảy và chạy trên mặt nước, K bùng cháy, Rb&Cs pư
mãnh liệt.
KLK
tác dụng dễ dàng với H2O nên người ta bảo quản nó trong dầu hỏa.
IV.
Ứng dụng, điều chế:
1.Ứng dụng : Chế
tạo hợp kim có t0nc thấp. Hợp kim Li-Al dùng trong kỉ thuật
hàng không. Cs làm tế bào quang điện
2. Điều chế : Khử
ion của KLK thành KL tự do M++e→M bằng cách Đpnc muối halogenua của
KLK
2NaCl2→Na+Cl2
V.
Hợp chất quan trọng của
kim loại kiềm:
1.
NaOH ( xút ăn da)
-
Là CR tan tốt trong nước.
Khi tan trong nước tỏa nhiều nhiệt
-
Là 1 bazo mạnh
+ Đổi màu chất
chỉ thị
+ Tác dụng với
axit ( cả axit rất yếu : phenol)
+ Tác dụng với
oxit axit
+ Tác dụng với
1 số muối
-
Điều chế : Điện
phân dung dịch muối ăn có màng ngăn :
2NaCl + 2H2O
-> 2NaOH + H2 + Cl2
2.
Na2CO3
( soda công nghiệp)
-
Tham gia phản ứng
trao đổi ion
-
Có môi trường kiềm mạnh
pH >7 : khi phản ứng với dd Al3+, Fe3+ thì phản ứng
theo cơ chế phản ứng thủy phân -> Hidroxit kết tủa và giải phóng CO2.
R2CO3
+ Al3+ + H2O -> Al(OH)3 + CO2 + R+
R2CO3
+ Fe3+ + H2O -> Fe(OH)3 + CO2 + R+
-
ứng dụng trong công
nghiệp sản xuất bột giặt, thủy tinh và xi măng.
3.
NaHCO3
(soda thực phẩm)
-
Có tính chất lưỡng
tính
+ Tác dụng
với dd axit mạnh -> CO2
+ Tác dụng
với dung dịch kiềm -> muối trung hòa.
-
Phản ứng nhiệt phân
Tất cả
các muối HCO3- -> muối trung hòa + CO2 + H2O
HCO3-
-> CO32- + CO2 + H2O
-
Dung dịch NaHCO3
có môi trường kiềm yếu do tính bazo của HCO3- trội hơn
tính axit -> dung dịch NaHCO3 có pH > 7
-
Ứng dụng trong sản xuất
công nghiệp bia, nước giải khát, giảm bệnh đau dạ dày
Phần 2. Ví dụ mẫu:
Câu 1. Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường:
A.
Na
B.
Fe
C.
Mg
D.
Al
Hướng
dẫn giải:
A
đúng vì Na là kim loại kiềm nên tan trong nước
Na
+ H2O -> NaOH+ 1/2H2
B,
C sai vì Fe, Mg tác dụng với nước ở nhiệt độ cao
D
sai vì Al không phản ứng với nước ( SGK12-NC trang 173)
Câu 2. Thực hiện các thí nghiệm sau:
1.
Cho dung dịch NaCl và dd KOH
2.
Cho dung dịch Na2CO3 vào dd Ca(OH)2
3.
Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn
4.
Cho dung dịch Cu(OH)2 vào dung dịch NaNO3
5.
Sục khí NH3 vào dung dịch
Na2CO3
6.
Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2
Các
thí nghiệm đều điều chế NaOH là:
A.
2,3,4
B.
1,2,3
C.
1,4,5
D.
2,5,6
Hướng
dẫn giải:
1,4,5 không phản ứng
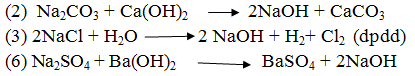
Phần 3 . Củng cố lý thuyết:
Câu 1: Đặc điểm nào sau đây không là đặc điểm chung cho các kim loại nhóm IA?
A.
Số
electron lớp ngoài cùng của nguyên tử
B.
Số
oxi hoá của các nguyên tố trong hợp chất
C.
Cấu
tạo mạng tinh thể của đơn chất
D.
Bán
kính nguyên tử
Câu 2: Nguyên tử của
các kim loại trong trong nhóm IA khác nhau về:
A.
số
electron lớp ngoài cùng của nguyên tử
B.
cấu
hình electron nguyên tử
C.
số
oxi hoá của nguyên tử trong hợp chất
D.
kiểu
mạng tinh thể của đơn chất
Câu 3. Điều khẳng định nào sau đây là sai?
A.
Trong
tự nhiên, các kim loại kiềm tồn tại nhiều với dạng hợp chất.
B.
Các
kim loại kiềm đều tác dụng với nước ở điều kiện thường.
C.
Cho
Na vào dung dịch CuSO4 thu được kết tủa màu đỏ.
D. Trong các phản ứng, các kim loại kiềm chỉ thể
hiện tính khử.
Câu 4: Nguyên tố có năng lượng ion hoá nhỏ nhất là:
A. Li B. Na C. K D. Cs
Câu 5 : Những nguyên tố nhóm IA của bảng tuần hoàn
được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của:
A. điện tích hạt nhân nguyên tử B.
khối lượng riêng
C. nhiệt độ sôi D. số oxi hoá
Câu 6. Cho các nhận định sau:
(1) Các kim loại kiềm đều có cấu hình là ns1.
(2) Các kim loại kiềm đều tan trong nước ở điều
kiện thường.
(3) Các kim loại kiềm là kim loại nhẹ, có tính khử mạnh.
(4) Các kim loại kiềm đều có cấu trúc lập phương
tâm khối. Số nhận định đúng là
A. 4 B. 2 C. 3 D. 1
Câu 7. Cho các nhận định sau:
(1) Các kim loại kiềm đều tác dụng với nước ở điều
kiện thường.
(2) Tính dẻo, tính dẫn điện, dẫn nhiệt và ánh kim
của kim loại đều do các electron tự do trong kim loại gây ra.
(3) Hợp kim của Mg được dùng để chế tạo tên lửa,
máy bay và ôtô.
(4) Các kim loại Li, Na, K, Cs đều có cấu trúc lập
phương tâm khối.
(5) Kim loại Liti (Li) có khối lượng riêng nhỏ nhất
trong tất cả các kim loại.
(6) Trong mọi hợp chất, các kim loại kiềm thổ chỉ
có một mức oxi hóa duy nhất là +2.
(7) Trong các phản ứng hóa học, các kim loại kiềm
đều thể hiện tính khử.
(8) Kim loại dẫn điện tốt nhất là Ag, sau đó đến
Cu, Au, Al và Fe. Số nhận định đúng là.
A. 8 B. 6 C. 4 D. 5
Câu 8: Dung dịch nào dưới đây cópH > 7?
A. FeCl3. B. K2SO4. C. Na2CO3. D.
Al2(SO4)3.
Câu 9: Trong các muối sau, muối nào dễ bị nhiệt
phân?
A. LiCl B. NaNO3 C. KHCO3 D.
KBr
Câu 10: Chất có tính lưỡng tính là:
A. NaCl. B. NaNO3. C. NaOH. D. NaHCO3.
Câu 11: Cho các dung dịch: NaOH; NaHCO3;
Na2CO3; NaHSO4; Na2SO4.
Các dung dịch làm cho quỳ tím đổi sang màu xanh là:
A. NaOH; Na2SO4; Na2CO3 C. NaOH; NaHCO3; Na2CO3
B. NaHSO4; NaHCO3; Na2CO3 D.
NaHSO4; NaOH; NaHCO3
Câu 12: Khi cho dung dịch NaOH dư vào cốc đựng dung
dịch Ca(HCO3)2 thì trong
cốc:
A. sủi bọt
khí. B. không có hiện tượng gì.
C. xuất hiện kết tủa trắng. D. có kết tủa trắng và bọt khí.
Câu 13: Cho từ từ
dung dịch HCl cho đến dư vào dung dịch Na2CO3. Hiện tượng
xảy ra là:
A.
lập
tức có khí thoát ra.
B.
không
có hiện tượng gì.
C.
đầu
tiên không có hiện tượng gì sau sau mới có khí bay ra.
D.
có
kết tủa trắng xuất hiện.
Câu 14: Sục khí CO2 từ từ tới dư qua dung
dịch nước vôi trong sau đó lại đun nóng dung dịch sau phản ứng. Hiện tượng xảy
ra là:
A.
Có
kết tủa trắng xuất hiện.
B.
Có
kết tủa sau rồi kết tủa tan.
C.
Không
có kết tủa dung dịch trong suốt.
D.
Có
kết tủa sau tan rồi lại xuất hiện kết tủa.
Câu 15: Hiện tượng xảy ra khi sục từ từ đến dư khí CO2
vào dung dịch hỗn hợp NaOH và Ba(OH)2 là:
A.
Dung
dịch vẩn đục, độ đục tăng dần đến cực đại và không đổi một thời gian sau đó giảm
dần đến trong suốt.
B.
Ban
đầu không có hiện tượng gì đến một lúc nào đó dung dịch vẩn đục, độ đục tăng dần
đến cực đại sau đó giảm dần đến trong suốt.
C.
Ban
đầu không có hiện tượng gì sau đó xuất hiện kết tủa và tan ngay.
D.
Dung
dịch vẩn đục, độ đục tăng dần đến cực đại sau đó giảm dần đến trong suốt.
Câu 16: Dùng phản ứng của kim loại với dung dịch muối
không thể chứng minh:
A. Cu có tính khử mạnh hơn Ag. B. Cu2+
có tính oxi hóa mạnh hơn Zn2+.
C. Fe3+ có tính oxi hóa mạnh hơn Fe2+. D. K
có tính khử mạnh hơn Ca.
Câu 17. Nhận định nào sau đây là sai?.
A.
Các
kim loại kiềm có màu trắng bạc, có tính khử
mạnh.
B.
Natri
được dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân.
C.
Trong
mọi hợp chất, các kim loại kiềm chỉ có một mức oxi hóa là +1.
D.
Trong
phân nhóm chính nhóm IA, chỉ chứa
các kim loại kiềm.
Câu 18: Cho bốn hỗn hợp, mỗi hỗn hợp gồm hai chất rắn
có số mol bằng nhau: Na2O và Al2O3; Cu và Fe2O3;
BaCl2 và CuSO4; Ba và NaHCO3. Số hỗn hợp có
thể tan hoàn toàn trong nước (dư) chỉ tạo ra dung dịch là:
A. 1. B. 2. C. 4. D. 3.
Câu 19: Trong các dung dịch: HNO3, NaCl,
Na2SO4, Ca(OH)2, KHSO4, Mg(NO3
)2, dãy gồm các chất đều tác dụng được với dung dịch Ba(HCO3)2
là:
A. HNO3, NaCl, Na2SO4. B. HNO3, Ca(OH)2, KHSO4, Na2SO4.
C. NaCl, Na2SO4, Ca(OH)2. D. HNO3,
Ca(OH)2, KHSO4, Mg(NO3)2.
(Trích đề thi tuyển sinh ĐH – CĐ khối B – 2007)
Câu 20: Dãy các chất tác dụng với dung dịch HCl là:
A. Mg3(PO4)2,
ZnS, Ag, Na2SO3, CuS B. Mg3(PO4)2,
ZnS, Na2SO3
C. Mg3(PO4)2,
ZnS, CuS, NaHSO4 D. Mg3(PO4)2,
NaHSO4, Na2SO3
Câu 21: Cho dãy các chất: KOH, Ca(NO3)2,
SO3, NaHSO4, Na2SO3, K2SO4.
Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là:
A. 4. B. 6. C. 3. D. 2.
(Trích đề thi tuyển sinh Cao đẳng – 2008)
Câu 22: Cho các dung dịch sau: Ba(OH)2;
NaCO3; MgCl2; Ca(HCO3)2. Số phản
ứng xảy ra giữa 2 chất một là:
A. 4 B. 3 C. 5 D. 6
Câu 23: Có 4 dung dịch: Ba(OH)2, Na2CO3,
NaHCO3 và NaHSO4. Khi trộn lẫn với nhau từng đôi một, số
cặp dung dịch tác dụng được với nhau là:
A. 2. B. 4. C. 5. D. 6.
Câu 24: Phản ứng nào sau đây không tạo ra hai muối?
A. Fe3O4 + HCl dư B. Ca(HCO3)2 + NaOH dư
C. CO2 + NaOH dư D. NO2 + NaOH dư
Câu 25: Hỗn hợp X chứa Na2O, NH4Cl,
NaHCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn
hợp X vào H2O (dư), đun nóng, dung dịch thu được chứa:
A. NaCl, NaOH. B. NaCl.
C. NaCl, NaHCO3, NH4Cl, BaCl2. D. NaCl, NaOH, BaCl2.
(Trích đề thi tuyển sinh ĐH – CĐ khối B – 2007)
Câu 26: Cho dung dịch chứa a mol NaHCO3
vào dung dịch chứa b mol Ba(OH)2 (biết b < a < 2b). Sau khi
phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa, dung dịch nước lọc thu được chứa:
A. NaOH, Na2CO3 B. NaHCO3, Na2CO3
C. NaOH, Ba(OH)2 D. NaHCO3, Ba(HCO3)2
Câu 27: X, Y, Z là 3 hợp chất của một kim loại hóa
trị I khi đốt cháy ở nhiệt độ cao cho ngọn lửa màu vàng. X tác dụng với Y tạo
thành Z. Nung nóng Y thu được chất Z và 1 chất khí làm đục nước vôi trong nhưng
không làm mất màu dung dịch nước Brom. X, Y, Z lần lượt là:
A. K2CO3, KOH và KHCO3
B. NaHCO3, NaOH và Na2CO3
C. Na2CO3, NaHCO3 và NaOH
D. NaOH, NaHCO3 và Na2CO3
Câu 28: Cho a mol NO2
hấp thụ hoàn toàn vào dung dịch chứa a mol NaOH. pH của dung dịch thu được là
?
A. 7. B. 0. C. > 7. D. < 7.
Câu 29: Những đặc điểm nào sau đây phù hợp với tính
chất của muối NaHCO3 :
(1) Chất lưỡng tính ;
(2) Kém bền với nhiệt ;
(3) Thuỷ phân cho môi trường kiềm mạnh ;
(4) Thuỷ phân cho môi trường kiềm yếu ;
(5) Thuỷ phân cho môi trường axit ;
(6) Chỉ tác dụng với axit mạnh.
A.
1, 2, 4. B. 2, 4, 6. C. 1, 2, 3. D. 2, 5, 6.
Câu 30: Tính chất nào nêu dưới nay sai khi nói về 2 muối NaHCO3
và Na2CO3 ?
A.
Cả
2 đều dễ bị nhiệt phân.
B.
Cả
2 đều tác dụng với axit mạnh giải phóng khí CO2.
C.
Cả
2 đều bị thủy phân tạo môi trường kiềm.
D.
Chỉ
có muối NaHCO3 tác dụng với dd NaOH.
Câu 31: Cho các chất rắn: Al2O3,
ZnO, NaOH, Al, Zn, Na2O, K2O, , Ba. Chất rắn nào có thể
tan hoàn toàn trong dung dịch KOH dư ?
A. Al, Zn, . B. ZnO, Al2O3, Na2O; KOH.
C. Al, Zn, ,
ZnO, Al2O3. D. Tất cả chất rắn đã cho.
Câu 32: Sục khí CO2
đến dư vào dung dịch NaAlO2. Hiện tượng xảy ra là
A.
Dung
dịch vẫn trong suốt, không có hiện tượng gì.
B.
Có
kết tủa trắng tạo thành, kết tủa không tan khi CO2 dư.
C.
Ban
đầu dung dịch vẫn trong suốt, sau đó mới có kết tủa trắng.
D. Ban đầu có kết tủa, sau đó kết tủa tan tạo
dung dịch trong suốt.
Câu 33: Cho sơ đồ
biến hoá: Na X Y Z T Na. Hãy chọn thứ tự đúng của các chất X,Y,Z,T
A. Na2CO3 ; NaOH ; Na2SO4 ; NaCl.
B. NaOH ; Na2SO4 ; Na2CO3
; NaCl
C. NaOH ; Na2CO3 ; Na2SO4 ; NaCl.
D. Na2SO4 ; Na2CO3
; NaOH ; NaCl.
Câu 34: Hỗn hợp X chứa Na2O, NH4NO3,
NaHCO3 và Ba(NO3)2 có số mol mỗi chất đều bằng
nhau. Cho hỗn hợp X vào H2O (dư), đun nóng, dung dịch thu được chứa
A. NaNO3, NaOH, Ba(NO3)2.
B. NaNO3, NaOH.
C. NaNO3, NaHCO3, NH4NO3, Ba(NO3)2.
D. NaNO3.
Câu 35: X, Y, Z là các hợp chất vô cơ của một kim
loại, khi đốt nóng ở nhiệt độ cao cho ngọn lửa màu tím. X tác dụng với Y thành
Z. Nung nóng Y ở nhiệt độ cao thu được Z, hơi nước và khí E. Biết E là hợp chất
của cacbon, E tác dụng với X cho Y hoặc Z. X, Y, Z, E lần lượt là những chất
nào sau đây?
A. KOH, K2CO3, KHCO3, CO2.
B. KOH, KHCO3, K2CO3, CO2.
C. KOH, KHCO3, CO2, K2CO3.
D. KOH, K2CO3, CO2, KHCO3.
Câu 36 : Hòa tan hoàn toàn hỗn hợp X gồm BaO, NH4HCO3,
NaHCO3 (có tỷ lệ mol lần lượt là 5 : 4 : 2) vào nước dư, đun nóng.
Đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa :
A. NaHCO3 và Ba(HCO3)2 B. Na2CO3.
C. NaHCO3 D. NaHCO3 và (NH4)2CO3.
Câu 37 : Khi tiến hành thí nghiệm sinh ra các khí độc
như SO2, H2S, Cl2, NO2. Để hạn chế
các khí này thoát ra từ ống nghiệm một cách có hiệu quả nhất, chúng ta thường
nút ống nghiệm bằng bông tẩm:
A. Giấm ăn. B. Kiềm. C. Dung dịch HCl . D. Nước.
Câu 38: Chỉ dùng thêm
thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch:
H2SO4, BaCl2,
Na2SO4?
A. Quỳ tím B. Bột kẽm
C. Na2CO3 D. Một trong 3 hóa chất trên
Câu 39: Có thể phân
biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc
thử là:
A.
giấy quỳ tím. B. Zn. C. Al. D. BaCO3.
Câu 40: Cho 4 chất rắn đựng trong 4 lọ riêng biệt: Na2CO3;
CaCO3; Na2SO4; CaSO4.2H2O.
Để nhận biết 4 lọ hoá chất trên người ta có thể dùng:
A. H2O và dung dịch NaOH
B. H2O và dung dịch HCl
C. H2O và dung dịch BaCl2
D. Không cần dùng hoá chất khác
Câu 41: Nếu chỉ được dùng thêm 1 dung dịch để nhận
biết các kim loại đựng riêng biệt: Na, Mg, Al, Fe thì đó là dung dịch nào trong
các dung dịch sau:
A. dung dịch BaCl2 B. dung
dịch Ba(OH)2
C. dung dịch NaOH D. dung dịch FeCl3
Câu 42: Cho 4 ống nghiệm đựng dung dịch các chất sau:
Na2CO3; BaCl2; HCl; NaOH. Để nhận biết các ống
nghiệm trên số hoá chất tối thiểu phải dùng là:
A. 1 chất
B. 2 chất
C. 3 chất
D. không cần dùng thuốc thử
Câu 43: Muối Na2CO3
bị lẫn tạp chất là NaHCO3. Dùng cách nào sau đây để loại bỏ được tạp
chất trên?
A. Hoà tan vào nước rồi lọc.
B. Hoà tan trong HCl rồi cô cạn.
C. Hoà tan trong NaOH dư rồi cô cạn.
D. Nung đến khối lượng không đổi.
Câu 44: Cho dung dịch chứa các ion sau (Na+,
Ca2+, Mg2+, Ba2+, H+, Cl-).
Muốn tách được nhiều cation nhất ra khỏi dung dịch mà không đưa ion lạ vào dung
dịch, ta có thể cho dung dịch tác dụng với chất nào trong các chất sau:
A. Dung dịch K2CO3 vừa đủ
B. Dung dịch Na2SO4 vừa đủ
C. Dung dịch NaOH vừa đủ
D. Dung dịch Na2CO3 vừa đủ
Câu 45: Cho một dung
dịch chứa các ion: Na+, Ca2+, Mg2+, Ba2+,
H+, Cl-. Để loại bỏ hết các ion Ca2+, Mg2+,
Ba2+, H+ ra khỏi dung dịch ban đầu, cần dùng dung dịch
chứa:
A. K2CO3 B. NaOH C. Na2SO4 D.
AgNO3
Câu46 : Trong phòng thí nghiệm, người ta thường điều
chế clo bằng cách:
A.
điện
phân nóng chảy NaCl.
B.
cho
dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C.
điện
phân dung dịch NaCl có màng ngăn.
D.
cho
F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 47: Để điều chế Na người ta có thể dùng phương
pháp:
A.
Điện
phân dung dịch NaOH hoặc NaCl.
B.
Điện
phân nóng chảy NaOH hoặc NaCl.
C.
Dùng
kim loại Mg tác dụng với dung dịch NaCl.
D.
Khử
Na2O thành Na bằng chất khử như CO; H2; .....
Câu 48: Để điều chế Na người ta dùng phương pháp nào
sau đây ?
A. Nhiệt phân NaNO3.
B. Điện phân dung dịch NaCl.
C. Điện phân NaCl nóng chảy.
D. Cho K phản ứng với dung dịch NaCl.
Câu 49:Thực hiện các
thí nghiệmsau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3vào
dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCl vớiđiện cực trơ, có
màng ngăn.
(IV) Cho Cu(OH)2vào dung dịch NaNO3.
(V) SụckhíNH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4vào
dung dịch Ba(OH)2.
Các thí nghiệmđều điều chế được
NaOH là
A. II, III và VI. B. I,
II và III. C.
I, IV và V. D. II, V và VI.
(Trích đề thi tuyển sinh ĐH – CĐ khối B – 2009)
Câu 50: Có thể điều chế trực tiếp NaOH từ những chất
nào sau đây.
A. Na2CO3; Na2O; Na2HCO3 B. Na; Na2CO3; NaCl
C. NaAlO2; NaCl; Na2SO4 D. Na2O; NaHCO3; NaCl
Câu 51: Trong công
nghiệp, natri hiđroxit được sản xuất bằng phương pháp:
A.
điện
phân dung dịch NaCl, không có màng ngăn điện
cực.
B.
điện
phân dung dịch NaNO3, không có màng ngăn điện cực.
C.
điện
phân dung dịch NaCl, có màng ngăn điện cực.
D.
điện
phân NaCl nóng chảy.
(Trích đề thi tuyển sinh Cao đẳng – 2007)
Câu 52: Từ dung dịch Na2CO3 ta
có thể điều chế Na bằng cách
A.
Cô
cạn dung dịch rồi điện phân Na2CO3 nóng chảy.
B.
Chuyển
dung dịch Na2CO3 thành dung dịch NaCl, cô cạn rồi điện
phân nóng chảy NaCl
C.
Chuyển
dung dịch Na2CO3 thành dung dịch NaCl, rồi điện phân dung
dịch NaCl
D.
Điện
phân dung dịch Na2CO3
.
Câu 53. Trong công
nghiệp, natri hydroxit (NaOH) được điều chế bằng cách.
A.
Cho
dung dịch Ba(OH)2 vào dung dịch Na2SO4.
B.
Cho
Na vào nước dư.
C.
Điện
phân dung dịch NaCl có màng ngăn.
D. Điện phân dung dịch NaCl không có màng ngăn.
Phần 4.
Đáp án
|
1.D |
2.B |
3.A |
4.D |
5.A |
6.A |
7.A |
|
8.C |
9.C |
10.D |
11.C |
12.C |
13.C |
14.D |
|
15.A |
16.D |
17.D |
18.A |
19.B |
20.B |
21.A |
|
22.C |
23.C |
24.C |
25.B |
26.A |
27.D |
28.C |
|
29.A |
30.A |
31.D |
32.B |
33.C |
34.D |
35.B |
|
36.B |
37.B |
38.D |
39.D |
40.B |
41.D |
42.D |
|
43.D |
44.D |
45.A |
46.B |
47.B |
48.C |
49.A |
|
50.B |
51.C |
52.B |
53.C |
54. |
55. |
56. |







