CHUYÊN ĐỀ: LÝ THUYẾT VỀ SẮT VÀ CÁC HỢP CHẤT CỦA SẮT
A. Sắt
I. Cấu tạo, vị trí trong bảng tuần hoàn:
- Cấu hình e nguyên tử: 26Fe: 1s22s22p63s23p63d64s2.
- Vị trí: Fe thuộc ô 26, chu kì 4, nhóm VIIIB.
- Cấu hình e của các ion được tạo thành từ Fe:
Fe2+ 1s22s22p63s23p63d6
Fe3+ 1s22s22p63s23p63d5
II. Tính chất vật lý:
- Kim loại màu trắng xám, ánh kim, dẻo, dễ rèn
- Có khả năng bị nhiễm từ, bản thân nó có thể bị nam châm hút hoặc tạo ra nam châm.
III. Tính chất hóa học:
- Fe là kim loại có tính khử trung bình tùy thuộc mức độ chất OXH tương tác, sản phẩm thu được có thể là Fe2+ hoặc Fe3+

c. Dung dịch AgNO3dư
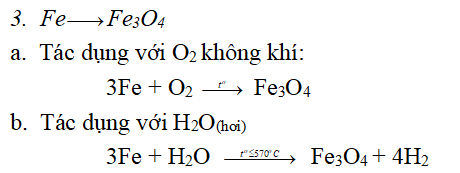
I. Trạng thái tự nhiên:
1. Dạng tự do: các mảnh thiên thạch
2. Dạng hợp chất
- Quặng sắt:
+ pirit FeS2
+ manhetit Fe3O4
+ hematit nâu Fe2O3.nH2O
Hematit đỏ Fe2O3 khan
+ xiderit FeCO3
- máu người và động vật
II. Sản xuất Fe
1. Gang
a. Khái niệm:
- là hợp kim của Fe và C trong đó hàm lượng C từ 2-5% và một số rất ít nguyên tố hóa học khác
b. Sản xuất gang:
- Nguyên liệu:
+ không khí: cung cấp O2
+ quặng sắt: manhetit hoặc hematit
+ than cốc
+ chất chảy có khả năng phản ứng với các tạp chất trong nguyên liệu sản xuất tạo ra xỉ nổi trên bề mặt gang, bảo vệ gang tránh tiếp xúc với không khí
- Nguyên tắc: dùng khí CO để khử dần oxit sắt có trong quặng
2. Thép
a. Khái niệm
- là hợp kim của Fe và C trong đó hàm lượng C từ 0,01-2% và một lượng rất ít các nguyên tố hóa học khác
b. Sản xuất thép:
- Nguyên liệu
+ Sắt, thép phế liệu, gang
+ không khí giàu O2
+ Nhiên liệu: không dùng than cốc mà dùng dầu mazut
+ Chất chảy: thường dùng CaCO3
- Nguyên tắc: dùng khí O2 có trong không khí để OXH các nguyên tố tạp chất trong gang nhằm làm giảm các nguyên tố tạp chất này đến hàm lượng mong muốn trong thép
B. CÁC HỢP CHẤT CỦA SẮT
I. Hợp chất của Fe(II)
- Chứa sắt mang số OXH +2
- Gồm FeO, Fe(OH)2, các muối sắt (II)
1. Tính chất hóa học đặc trưng:
- TCHH đặc trưng của tất cả các hợp chất Fe(II) là tính khử khi tác dụng với chất OXH phù hợp sẽ tạo ra hợp chất Fe(III)
a. FeO
- tác dụng với HNO3, H2SO4đặc, muối NO3-/H+, O2
b. Fe(OH)2
- tác dụng với O2/H2O, HNO3, H2SO4đặc, muối NO3-/H+
c. Muối Fe2+
- Tác dụng với Ag+, HNO3, H2SO4đặc, muối NO3-/H+, halogen khác I2, O2, KMnO4, K2Cr2O7
2. Một số hợp chất Fe2+ còn có tính OXH
- khi tác dụng với chất khử
- VD:
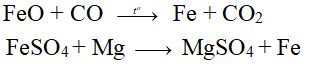
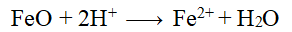
3. Ngoài ra các hợp chất Fe2+ còn mang những tính chất đặc trưng của nó
a. FeO: oxit bazo không tan, màu đen
- Tác dụng với dung dịch axit mạnh khác HNO3, H2SO4đặc
b. Fe(OH)2: bazo không tan, màu trắng xanh
- Tác dụng với dung dịch axit mạnh khác HNO3, H2SO4đặc
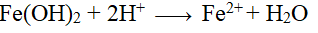
- Bị nhiệt phân

c. Muối Fe2+: tham gia phản ứng trao đổi ion
4. Điều chế hợp chất Fe(II)
- Rất khó, luôn phải trong điều kiện không có không khí, dụng cụ sạch
a. FeO: nhiệt phân FeCO3/Fe(OH)2 không có không khí
b. Fe(OH)2: cho dung dịch muối Fe2+ tác dụng với dung dịch kiềm không có không khí
c. Muối Fe2+
- FeCl2, FeSO4: cho Fe, FeO, Fe(OH)2 tác dụng với dung dịch HCl, H2SO4 loãng
- Fe(NO3)2: cho Fe dư vào dung dịch Fe(NO3)3
Chú ý: Trong thực tế để bảo quản dung dịch Fe2+ phải cho một đinh sắt vào dung dịch muối đó
II. Hợp chất Fe(III)
- Chứa ion sắt mang số OXH +3 (cao nhất)
- Gồm Fe2O3, Fe(OH)3, muối Fe3+
1. Tính chất hóa học đặc trưng của hợp chất Fe3+ là tính OXH
- Tùy thuộc mức độ chất khử tương tác mà sản phẩm thu được có thể là hợp chất Fe2+ hoặc Fe3+
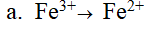
- tác dụng với chất khử trung bình: I-, S2-, kim loại từ Fe đến Cu

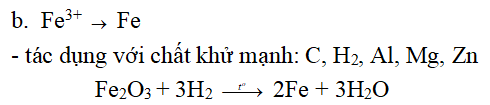
2. Mang tính chất vốn có của nó
a. Fe2O3: oxit bazo không tan, tác dụng với mọi dung dịch axit mạnh đều thu được sản phẩm là hợp chất Fe3+
b. Fe(OH)3: bazo không tan, màu nâu đỏ
- Khi nhiệt phân hoặc tác dụng với mọi dung dịch axit mạnh đều thu được sản phẩm là hợp chất Fe3+
c. Dung dịch muối Fe3+
- phản ứng trao đổi ion
3. Điều chế hợp chất Fe3+
a. Fe2O3:
- nung Fe(OH)3
- nung Fe(OH)2 trong không khí
b. Fe(OH)3:
- cho dung dịch muối Fe3+ tác dụng với OH-
c. Dung dịch muối Fe3+
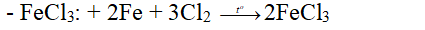
- Fe2(SO4)3
+ Fe hoặc hợp chất của Fe tác dụng với H2SO4 đặc, nóng, dư
+ Fe2O3, Fe(OH)3 tác dụng với H2SO4 loãng
- Fe(NO3)3: Fe hoặc hợp chất của Fe tác dụng với dung dịch HNO3 dư
III. Fe3O4 (FeO.Fe2O3)
1. Tính khử
- Tác dụng với HNO3, H2SO4đặc, muối NO3-/H+, O2
2. Tính oxi hóa
- Tác dụng với CO, H2, Al, C
3. Tính chất vốn có:
- là oxit bazo hỗn hợp nên khi tác dụng với dung dịch axit mạnh khác HNO3, H2SO4đặc thu được hỗn hợp 2 muối
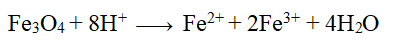
C. BÀI TẬP TỰ LUYỆN
Câu 1: Tính chất vật lí nào dưới đây không phải là tính chất vật lí của sắt:
A. Kim loại nặng, khó nóng chảy
B. Màu vàng nâu, dẻo, dễ rèn
C. Dẫn điện và nhiệt tốt
D. Có tính nhiễm từ
Đáp án: B
Câu 2: Cho phương trình phản ứng:
X + HNO3 → Fe(NO3)3 + NO + H2O .
Có thể có bao nhiêu hợp chất là X chứa 2 nguyên tố thỏa mãn phương trình trên .
A. 4 B. 3 C. 5 D. 2
Đáp án: D
Câu 3: Cho hỗn hợp gồm Fe và Zn vào dung dịch AgNO3 đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X là:
A. Fe(NO3)2 và AgNO3.
B. AgNO3 và Zn(NO3)2.
C. Zn(NO3)2 và Fe(NO3)2.
D. Fe(NO3)3 và Zn(NO3)2.
Đáp án: C
Câu 4: Hoà tan một lượng Fe vào dung dịch H2SO4 loãng thấy thoát ra V1 lít khí H2. Mặt khác nếu hoà tan cùng một lượng Fe trên vào dung dịch H2SO4 đặc nóng thấy thoát ra V2 lít khí SO2 (các thể tích đo ở cùng điều kiện). Mối quan hệ giữa V1 và V2 là :
A.V1 = 2V2 B. 2V1 = V2
C. V1 = V2 D. 3V1 = 2V2
Đáp án: D
Câu 5: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng (dư) được dung dịch X1. Cho lượng dư bột Fe vào dung dịch X1 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được dung dịch X2 chứa chất tan là:
A. Fe2(SO4)3 và H2SO4. B. FeSO4.
C. Fe2(SO4)3 D. FeSO4 và H2SO4.
Đáp án: B
Câu 6: Trong các chất: FeCl2 , FeCl3 , Fe(NO3)3 , Fe(NO3)2 , FeSO4 , Fe2(SO4)3 . Số chất có cả tính oxi hoá và tính khử là:
A. 2. B. 5. C. 3. D. 4.
Đáp án: D
Câu 7: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3,
FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá - khử là
A. 8. B. 5. C. 7. D. 6.
Đáp án: C
Câu 8: Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
A. nhận 12 electron. B. nhận 13 electron.
C. nhường 12 electron. D. nhường 13 electron.
Đáp án: D
Câu 9: Phản ứng nào dưới đây tạo thành sản phẩm là muối sắt (II) ?
A. FeSO4 + Ba(NO3)2
B. Fe + HNO3 loãng
C. Fe + Cl2
D. Fe(OH)2 + HNO3 đặc, nóng
Đáp án: A
Câu 10: Nhúng thanh sắt vào dung dịch CuSO4. Hiện tượng quan sát được là:
A. Thanh sắt có màu trắng và dung dịch nhạt dần màu xanh
B. Thanh sắt có màu đỏ và dung dịch nhạt dần màu xanh
C. Thanh sắt có màu trắng xám và dung dịch có màu xanh
D. Thanh sắt có màu đỏ và dung dịch có màu xanh
Đáp án: B







