A. Kiếm thức cơ bản
1. Đồng phân, danh pháp
- Công thức tổng quát: RXn
- Phân loại: theo bản chất, số lượng nguyên tử halogen và đặc điểm cấu tạo gốc hidrocacbon
- Bậc của dẫn xuất halogen = bậc C liên kết với X
- Đồng phân: gồm đồng phân mạch cacbon và đồng phân vị trí X
- Tên gọi: + Tên gốc – chức: Tên gốc hidrocacbon + halogen
+ Tên thay thế: Số chỉ X- tên X + tên hidrocacbon .
2. Tính chất hóa học
a) Phản ứng thế nguyên tử halogen X
PTTQ: RXn + nNaOH → R (OH)n + nNaX
b) Phản ứng tách HX
R1R2CX- CH2R3 → R1R2C = CHR3 + HX (xúc tác: kiềm/ ancol, to)
B. Bài tập
Bài 1 trang 177 sgk Hóa học lớp 11
Gọi tên mỗi chất sau: CH3- CH2Cl; CH2 = CH- CH2Cl; CHCl3; C6H5Cl. Viết phương trình hóa học của các phản ứng điều chế mỗi chất trên từ hidrocacbon tương ứng.
Hướng dẫn giải:
CH3- CH2Cl : etyl clorua (cloetan);
CH2 = CH- CH2Cl: anlyl clorua (1-cloprop- 2-en);
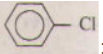 phenyl clorua (clobenzen)
phenyl clorua (clobenzen)
CHCl3: clorofom (triclometan)
Điều chế các chất trên từ hidrocacbon tương ứng:
CH3CH3 + Cl2 \[\overset{askt}{\mathop{\to }}\,\] CH3- CH2Cl + HCl
CH2=CH-CH3 + Cl2 \[\overset{{{450}^{0}}}{\mathop{\to }}\,\] CH2 = CH- CH2Cl
CH4 + 3Cl2 \[\overset{askt}{\mathop{\to }}\,\] CHCl3 + 3HCl
 + Cl2 \[\overset{{{t}^{0}},Fe}{\mathop{\to }}\,\]
+ Cl2 \[\overset{{{t}^{0}},Fe}{\mathop{\to }}\,\] 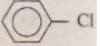 + 3HCl
+ 3HCl
Bài 2 trang 177 sgk Hóa học lớp 11
Viết phương trình phản ứng hóa học của phản ứng thủy phân các chất sau trong dung dịch NaOH: 1,2- đicloetan; benzyl clorua, anylyl bromua; xiclohexyl clorua.
Hướng dẫn giải:
ClCH2- CH2Cl + 2 NaOH \[\overset{{{t}^{0}}}{\mathop{\to }}\,\] HOCH2- CH2OH + 2 NaCl
C6H5-CH2-Cl + NaOH \[\overset{{{t}^{0}}}{\mathop{\to }}\,\] C6H5-CH2-OH + NaCl
CH2=CH-CH2-Br + NaOH \[\overset{{{t}^{0}}}{\mathop{\to }}\,\] CH2=CH-CH2-OH + NaBr
C6H11-Cl + NaOH \[\overset{{{t}^{0}}}{\mathop{\to }}\,\] C6H11-OH + NaCl
Bài 3 trang 177 sgk Hóa học lớp 11
Cho nhiệt độ sôi (0C) của một số dẫn xuất halogen trong bảng dưới đây
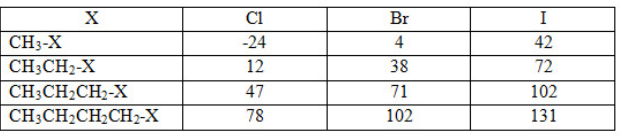
Hướng dẫn giải:
Dãy các chất CH3Cl, CH3Br, CH3I có nhiệt độ sôi tăng dần do phân tử khối tăng dần.
CH3X, CH3CH2X, CH3CH2CH2X, CH3CH2CH2CH2X có nhiệt độ sôi tăng dần do phân tử khối tăng dần.
Bài 4 trang 177 sgk Hóa học lớp 11
Từ axetilen, viết phương trình hóa học của các phản ứng điều chế: etyl bromua(1); 1,2- đibrometan (2); vinyl clorua (3); 1,1- đibrometan (4).
Hướng dẫn giải:
(1) điều chế etyl bromua
CH≡CH + H2 \[\overset{Ni,{{t}^{0}}}{\mathop{\to }}\,\] C2H6
CH3-CH3 + Br2 \[\overset{a/s}{\mathop{\to }}\,\] CH3-CH2-Br + HBr
(2) điều chế 1,2-đibrometan
CH≡CH + H2 \[\overset{Pb/PbC{{O}_{3}},,{{t}^{0}}}{\mathop{\to }}\,\] CH2=CH2
CH2=CH2 + Br2 → CH3Br – CH3Br
(3) điều chế vinyl clorua
CH≡CH + HCl \[\overset{HgC{{l}_{2}},150-{{200}^{0}}C}{\mathop{\to }}\,\] CH2=CH-Cl
(4) điều chế 1,1 –đibrometan
CH≡CH + HBr \[\overset{{{t}^{0}},xt}{\mathop{\to }}\,\] CH2=CHBr
CH2=CHBr + HBr \[\overset{{{t}^{0}},xt}{\mathop{\to }}\,\] CH3CHBr2
Bài 5 trang 177 sgk Hóa học 11
Dùng hai ống nghiệm, với mỗi ống đựng 1ml một trong hai chất lỏng sau: etylbromua (1); brombenzen (2).
Thêm tiếp vào mỗi ống 1 ml dung dịch AgNO3. Đun sôi hai ống nghiệm, thấy ở ống 1 có kết tủa vàng nhạt, trong khi đó ở ống 2 không có hiện tượng gì. Nhận xét và giải thích các hiện tượng ở thí nghiệm trên.
Hướng dẫn giải:
Ống (1) CH3 – CH2Br + H2O → CH3- CH2OH + HBr
AgNO3 + HBr → AgBr + HNO3
Ống (2) không có phản ứng, chứng tỏ liên kết C- Br trong phản ứng brombenzen rất bền
Bài 6 trang 177 sgk Hóa học lớp 11
Khi đun nóng etyl clorua trong dung dịch chứa KOH và C2H5OH, thu được
A. Etanol
B. Etilen
C. Axetilen
D. Etan
Hướng dẫn giải:
Chọn B
